
- •Атом бора
- •Баланс мощности
- •8. Гипотеза де-Бройля. Опыты Дэвиссона и Джермера. Дифракция электронов, атомов и молекул. Корпускулярно-волновой дуализм. Особенности поведения микрообъектов.
- •Орядок заполнения ячеек.
- •Масса и энергия связи ядра
- •Модели атомного ядра
- •Ядерные силы
- •Радиоактивность
- •37.Альфа-распад радиоактивных ядер. Бета-распад. Спектр бета-частиц. Проблема массы нейтрино. Электронный захват (е-захват).
- •Свойства нейтрино Каждому заряженному лептону соответствует своя пара нейтрино/антинейтрино: электронное нейтрино/электронное антинейтрино; мюонное нейтрино/мюонное антинейтрино
- •39.Активность радиоактивного вещества. Единицы измерения активности. Радиоактивные семейства.
- •40.Ядерные реакции. Энергия реакции. Составное ядро. Время пролета. Эффективное сечение реакции.
- •41.Деление атомных ядер под действием нейтронов. Цепная ядерная реакция. Критическая масса. Атомная бомба. Ядерный реактор.
- •Термоядерные реакции
- •42.Синтез легких ядер. Термоядерный и инерционный синтез. Проблемы управляемого термоядерного синтеза. Термоядерные реакции
- •43.Виды взаимодействий и классы элементарных частиц. Фотоны, лептоны, мезоны, барионы, гипероны.
- •Методы регистрации элементарных частиц. Камера Вильсона. Диффузионная камера. Пузырьковая камера. Искровая камера. Эмульсионная камера.
- •Эмульсионная камера – нету
- •45 Космические лучи. Первичные и вторичные космические лучи. Радиационные пояса Земли. Мягкая и жесткая компоненты космических лучей.
- •Античастицы. Зарядовое сопряжение. Законы сохранения
- •Зарядовое сопряжение
- •Сохранение странности
- •Несохранение четности в слабых взаимодействиях. Опыт Ву
- •Свойства нейтрино
- •49. Систематика элементарных частиц. Кварковая модель адронов. Попытки обнаружения кварков.
- •Чёрные дыры
- •Белые карлики
1)Особенностью микромира, состоящего из мельчайших частиц (электронов, протонов, нейтронов, атомов, и т.д.) является то, что им присущи как волновые так и корпускулярные свойства, те проявление дуализма. Вследствие этого невозможно применение понятий и принципов классической физики. Попытки описать и объяснить объекты микромира привели к появлению квантовой механики, т.к. классическая физика не в силах была объяснить дуализм волны и частицы. Кроме того особенностью микромира является то, что при экспериментах неизбежно макроприборы и инструменты исследователей влияют на микрообъекты. Подобное воздействие не учитывается в классической физике. Принципиальное отличие описания законов микромира заключается в вероятностном характере этих описаний. Это означает, что нельзя точно предсказать место нахождения, например, электрона. Можно оценить лишь его шансы попадания в определенную точку. Поэтому применяются методы и понятия теории вероятности. В квантовой механике любое состояние описывается с помощью «волновой функции» (Y), но в отличие от классической физики эта функция определяет параметры будущего состояния не достоверно, а с определенной степенью вероятности. Например, говорят о вероятностном распределении значений, а не о конкретных значениях. Значение волновой функции становиться ясным из утверждения: вероятность нахождения электрона в определенном месте равно квадрату модуля волновой функции. В основе квантовой механики лежит принцип неопределенности. Суть принципа неопределенности заключается в следующем: если мы стремимся определить одну из сопряженных величин, например, координату x, то значение другой величины, нельзя определить с такой же точностью. Принцип неопределенности выражается формулой Dx Dp =h, где произведение приращения координаты и приращение импульса равно постоянной Планка. Или словами: невозможно с одинаковой точностью определить и положение, и импульс микрочастицы. Произведение их неточностей не должно превышать постоянную Планка. В силу кажущейся противоречивости корпускулярных и волновых свойств датский физик Нильс Бор выдвинул принцип дополнительности для квантово-механического описания микрообъектов, согласно которому корпускулярная картина такого описания должна быть дополнена волновым альтернативным описанием. Опираясь на этот принцип возможно понять и объяснить многие явления, например дифракцию электрона на никелевом кристалле. Принцип суперпозиций заключается в следующем: в каждой точке результат от действия нескольких источников (например, волн) в любой момент равен сумме результатов действий каждого источника в отдельности.
Постоя́нная
Пла́нка (квант действия) —
основная константа квантовой
теории,
коэффициент, связывающий величину
энергии кванта электромагнитного
излучения с
его частотой так же, как и вообще величину
кванта энергии любой линейной колебательной
физической системы с её частотой.
Связывает энергию и импульс
с частотой и пространственной
частотой,действия с фазой.
Является квантом момента
импульса.
Впервые упомянута Планком в
работе, посвящённой тепловому излучению,
и потому названа в его честь. Обычное
обозначение — латинское ![]() .Часто
применяется величина
.Часто
применяется величина ![]() :
:
называемая редуцированной (иногда рационализированной или приведённой) постоянной Планка или постоянной Дирака.
Международной системы единиц переопределить единицы измерений СИ таким образом, чтобы постоянная Планка была равной точно 6,62606·10−34 Дж·с,
В квантовой механике импульс имеет физический смысл волнового вектора, энергия — частоты, а действие — фазы волны, однако традиционно (исторически) механические величины измеряются в других единицах(кг·м/с, Дж, Дж·с), чем соответствующие волновые (м−1, с−1, безразмерные единицы фазы). Постоянная Планка играет роль переводного коэффициента (всегда одного и того же), связывающего эти две системы единиц — квантовую и традиционную:
![]() (импульс)
(импульс) ![]()
![]() (энергия)
(энергия)
![]() (действие)
(действие)
Постоянная
Планка имеет и простую оценочную роль
в разграничении областей применимости
классической и квантовой физики: она в
сравнении с величиной характерных для
рассматриваемой системы
величин действия или момента
импульса,
или произведений характерного импульса
на характерный размер, или характерной
энергии на характерное время, показывает,
насколько применима к данной физической
системе классическая
механика.
А именно, если ![]() —
действие системы, а
—
действие системы, а ![]() —
её момент импульса, то при
—
её момент импульса, то при ![]() или
или ![]() поведение
системы с хорошей точностью описывается
классической механикой. Эти оценки
достаточно прямо связаны с соотношениями
неопределенностей Гейзенберга.
поведение
системы с хорошей точностью описывается
классической механикой. Эти оценки
достаточно прямо связаны с соотношениями
неопределенностей Гейзенберга.
Класси́ческая фи́зика — физика до появления квантовой теории и теории относительности. Основы классической физики были заложены в Эпоху Возрождениярядом учёных, из которых особенно выделяют Ньютона — создателя классической механики.
Классическая физика основана на следующих принципах:
причины однозначно определяют следствия (детерминизм);
пространство и время являются абсолютными — это означает, что они никак не зависят от материи, заполняющей пространство и от её движения, при этом результаты измерения пространственных и временны́х отрезков не зависят от выбранной системы отсчёта, в частности, от скорости движения измеряемого объекта относительно наблюдателя;
изменения любых величин, характеризующих физическую систему, являются непрерывными — это значит, что при переходе от одного фиксированного состояния к другому физическая система проходит через бесконечное множество переходных состояний, в которых все физические параметры системы принимают промежуточные значения между значениями в начальном и конечном состояниях.
Квантовая теория
В 1900 г. немецкий физик Макс Планк предлагает Квантовую теорию излучения, согласно которой свет излучается не непрерывно (как это предполагается классической теорией), а дискретно — порциями, которые Планк назвал квантами. Несмотря на парадоксальность этой теории (в которой излучение света рассматривается, как волновой процесс, и, в то же время, как поток частиц — квантов), она хорошо описывала форму непрерывного спектра теплового излучения твёрдых и жидких тел.
В 1905 г. Альберт Эйнштейн, исходя из предположения квантовой природы света, даёт математическое описание явления фотоэффекта, при этом становится объяснимой природа красной границы фотоэффекта. (Именно за эту работу, а не за Теорию относительности, Эйнштейну в 1921 г. присуждается Нобелевская премия.)
В 1926 г. Нильс Бор предлагает Квантовую теорию атома, согласно которой электроны, составляющие электронную оболочку атома, могут находиться только всчётном множестве дискретных состояний (орбит) с фиксированными параметрами (квантовыми числами), а переходы электрона с орбиты на орбиту происходят при поглощении или излучении квантов света не непрерывно, а скачкообразно, без промежуточных состояний (См.Постулаты Бора). Таким образом, квантовый принцип, помимо света, распространялся и на движение электрона. Эта теория хорошо объясняла линейчатый спектр излучения и поглощения электромагнитных волн газами, а кроме того, позволяла понять физическую природу химического соединения, свойств химических элементов, и Периодического закона Менделеева.
В дальнейшем квантовая механика становится главным инструментом теоретической физики при описании процессов микромира. В ходе развития квантовой механики произошёл отказ от жёсткого детерминизма классической физики, и принят принцип неопределённости Гейзенберга (см.).
Благодаря квантовым представлениям удалось найти адекватные описания явлений, происходящих в ядрах атомов и в недрах звёзд, радиоактивности, физики элементарных частиц, физики твёрдого тела, физики низких температур (сверхпроводимости и сверхтекучести).
2)
1. Явление радиоактивного распада.
2. Фотоэффект.
3. Лазерное излучение.
При опыте Резерфорда (бомбардировке фольги а-частицами) было обнаружено отклонение траектории некоторых а-частиц почти на 180 градусов, что противоречило модели атома Томпсона (неделимый шарик напичканый электронами, как булка с изюмом). Опыт показал, что атом представляет собой положит. заряженное ядро, значительно меньшее по размеру, чем атом, но в котором сконцентрирована почти вся масса атома, и электронов, вращающихся по стационарным орбитам. Так называемая планетарная модель, противоречащая динамике Ньютона и электродинамике Максвелла. Отсюда началась эра квантовой механики и электродинамики. Ядро тоже само по себе имеет свойство делиться на составные части (радиоактивность). Электроны могут переходить из одного стационарного состояния в другое (лазерное излучение), и могут вообще покинуть атом полдучив квант энергии нужной частоты (фотоэффект)
Элемента́рный электри́ческий заря́д — фундаментальная физическая постоянная, минимальная порция (квант) электрического заряда. Равен приблизительно1,602 176 565(35)·10−19 Кл[1] .. Любой наблюдаемый в эксперименте электрический заряд всегда кратен элементарному — такое предположение было высказано Б. Франклином в 1752 году и в дальнейшем неоднократно проверялось экспериментально. Впервые заряд был экспериментально измерен Милликеном в 1910 году[2].
Тот факт, что электрический заряд встречается в природе лишь в виде целого числа элементарных зарядов, можно назвать квантованием электрического заряда В современной физике элементарных частиц разрабатываются модели наподобие преонной, в которых все известные фундаментальные частицы оказывались бы простыми комбинациями новых, ещё более фундаментальных частиц. В этом случае квантование заряда наблюдаемых частиц не представляется удивительным, поскольку оно возникает «по построению».
Не исключено также, что все параметры наблюдающихся частиц будут описаны в рамках единой теории поля, подходы к которой разрабатываются в настоящее время. В таких теориях величина электрического заряда частиц должна вычисляться из крайне небольшого числа фундаментальных параметров, возможно, связанных со структурой пространства-времени на сверхмалых расстояниях. Если такая теория будет построена, тогда то, что мы наблюдаем как элементарный электрический заряд, окажется некоторым дискретным инвариантом пространства-времени. Однако, конкретных общепринятых результатов в этом направлении пока не получено.
Электро́н (от др.-греч. ἤλεκτρον — янтарь[3]) — стабильная, отрицательно заряженная элементарная частица, одна из основных структурных единиц вещества. Является фермионом (то есть имеет полуцелый спин). Относится клептонам (единственная стабильная частица среди заряженных лептонов). Из электронов состоят электронные оболочки атомов, где их число и положение определяет почти все химические свойства веществ. Движение свободных электронов обусловливает такие явления, как электрический ток в проводниках и вакууме. Название «электрон» происходит от греческого слова ἤλεκτρον, означающего «янтарь»: ещё в древней Греции естествоиспытателями проводились эксперименты — куски янтаря тёрли шерстью, после чего те начинали притягивать к себе мелкие предметы. Термин «электрон» как название фундаментальной неделимой единицы заряда в электрохимии был предложен[4] Дж. Дж. Стоуни (англ.) в 1894 (сама единица была введена им в 1874). Открытие электрона как частицы принадлежит Э. Вихерту[5][6] и Дж. Дж. Томсону, который в 1897 установил, что отношение заряда к массе для катодных лучей не зависит от материала источника. (см. Открытие электрона)
Открытие
волновых свойств[7].
Согласно гипотезе де
Бройля (1924),
электрон (как и все другие материальные
микрообъекты) обладает не только
корпускулярными, но и волновыми
свойствами. Де-бройлевская
длина волны нерелятивистского
электрона равна ![]() ,
где
,
где ![]() —
скорость движения электрона. В соответствии
с этим электроны, подобно свету, могут
испытывать интерференцию и дифракцию.
Волновые свойства электронов были
экспериментально обнаружены
в 1927 американскими
физиками К.
Дэвиссоном и Л.
Джермером (Опыт
Дэвиссона — Джермера)
и независимо английским физикомДж.
П. Томсоном.
—
скорость движения электрона. В соответствии
с этим электроны, подобно свету, могут
испытывать интерференцию и дифракцию.
Волновые свойства электронов были
экспериментально обнаружены
в 1927 американскими
физиками К.
Дэвиссоном и Л.
Джермером (Опыт
Дэвиссона — Джермера)
и независимо английским физикомДж.
П. Томсоном.
3) В принципе, свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, гидратированных или сольватированных, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов[9]. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
энергия ионизации атомов;
энергия сродства атомов к электрону;
электроотрицательность;
атомные (и ионные) радиусы;
энергия атомизации простых веществ
степени окисления;
окислительные потенциалы простых веществ.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие охимическом элементе, были уточнены представления о простых веществах и соединениях.
Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в XX веке проявилась в оценке химических свойств трансурановых элементов.
Разработанная в XIX в. в рамках науки химии, периодическая таблица явилась готовой систематизацией типов атомов для новых разделов физики, получивших развитие в начале XX в. — физики атома и физики ядра. В ходе исследований атома методами физики было установлено, что порядковый номер элемента в таблице Менделеева (атомный номер) является мерой электрического заряда атомного ядра этого элемента, номер горизонтального ряда (периода) в таблице определяет число электронных оболочек атома, а номер вертикального ряда — квантовую структуру верхней оболочки, чему элементы этого ряда и обязаны сходством химических свойств.
Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
4) Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее изучены. Они хорошо подчиняются формуле Ридберга:
![]() ,
,
где
R = 109 677 см−1 — постоянная
Ридберга для
водорода, ![]() —
основной уровень серии. Спектральные
линии возникающие при переходах на
основной энергетический уровень
называются резонансными, все остальные —
субординатными.
—
основной уровень серии. Спектральные
линии возникающие при переходах на
основной энергетический уровень
называются резонансными, все остальные —
субординатными.
Для описания длин волн λ четырёх видимых линий спектра водорода И. Бальмер предложил формулу
![]()
где n = 3, 4, 5, 6; b = 3645,6 Å.
Серия Лаймана
Открыта Т. Лайманом в 1906 году. Все линии серии находятся в ультрафиолетовом диапазоне. Серия соответствует формуле Ридберга при n' = 1 и n = 2, 3, 4,… Линия Lα = 1216 Å является резонансной линией водорода. Граница серии — 911,8 Å.
Серия Бальмера
Открыта И. Я. Бальмером в 1885 году. Первые четыре линии серии находятся в видимом диапазоне. Серия соответствует формуле Ридберга при n' = 2 и n = 3, 4, 5,… Линия Hα = 6565 Å. Граница серии — 3647 Å.
Серия Пашена
Предсказана Ритцем в 1908 году на основе комбинационного принципа. Открыта Ф. Пашеном в том же году. Все линии серии находятся в инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 3 и n = 4, 5, 6,… Линия Pα = 18756 Å. Граница серии — 8206 Å.
Серия Брэккета
Открыта Ф. С. Брэккетом в 1922 году. Все линии серии находятся в далёком инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 4 и n = 5, 6, 7,… Линия Bα = 40522 Å. Граница серии — 14588 Å.
Серия Пфунда
Открыта А. Г. Пфундом в 1924 году. Все линии серии находятся в далёком инфракрасном диапазоне. Серия соответствует формуле Ридберга при n' = 5 и n = 6, 7, 8,… Линия Pfα = 74598 Å. Граница серии — 22794 Å.
Спектра́льный терм или электро́нный терм атома, молекулы или иона — конфигурация (состояние) электронной подсистемы, определяющая энергетический уровень. Иногда под словом терм понимают собственно энергию данного уровня. Переходы между термами определяют спектры испускания и поглощения электромагнитного излучения.
5)
Модель Томсона (иначе называемая «пудинговая модель атома») — модель атома, предложенная в 1904 году Джозефом Джоном Томсоном. Открыв в 1897 году электрон, Томсон предположил, что электроны являются составными частями атома и решил создать модель атома, отражающую это предположение.
С точки зрения Томсона:
…атомы элементов состоят из нескольких отрицательно заряженных корпускул, заключённых в сферу, имеющую однородно распределённый положительный электрический заряд…
Атом по Томсону состоит из электронов, помещённых в положительно заряженный «суп», компенсирующий отрицательные заряды электронов, подобно отрицательно заряженным «изюминкам» в положительно заряженном «пудинге». Электроны, как предполагалось, были распределены по всему атому. Было несколько вариантов возможного расположения электронов внутри атома, в частности вращающиеся кольца электронов. В некоторых вариантах модели вместо «супа» предлагалось «облако» положительного заряда.
Согласно этой модели, электроны могли свободно вращаться в капле или облаке такой положительно заряженной субстанции. Их орбиты стабилизировались тем, что, при удалении электрона от центра положительно заряженного облака, он испытывал увеличение силы притяжения, возвращающей его обратно, поскольку внутри его орбиты было больше вещества противоположного заряда, чем снаружи (по закону Гаусса). В модели Томсона электроны могли свободно вращаться по кольцам, которые стабилизировались взаимодействиями между электронами, а спектры объясняли энергетические различия между различными кольцевыми орбитами.
Планетарная модель атома, или модель Резерфорда, - историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеянием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, - подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома. Новую модель строения атома Резерфорд предложил в 1911 году как вывод из эксперимента по рассеянию альфа-частиц на золотой фольге, проведённого под его руководством. При этом рассеянии неожиданно большое количество альфа-частиц рассеивалось на большие углы, что свидетельствовало о том, что центр рассеяния имеет небольшие размеры и в нём сосредоточен значительный электрический заряд. Расчёты Резерфорда показали, что рассеивающий центр, заряженный положительно или отрицательно, должен быть по крайней мере в 3000 раз меньше размера атома, который в то время уже был известен и оценивался как примерно 10-10 м. Поскольку в то время электроны уже были известны, а их масса и заряд определены, то рассеивающий центр, который позже назвали ядром, должен был иметь противоположный электронам заряд. Резерфорд не связал величину заряда с атомным номером. Этот вывод был сделан позже. А сам Резерфорд предположил, что заряд пропорционален атомной массе.
Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро.
С точки зрения классических законов физики непонятна устойчивость атома и линейчатый характер атомных спектров. К началу XX века эмпирическим путем было установлено, что электроны представляют собой отрицательно заряженные частицы, являющиеся составной частью атома. Электрический ток является ничем иным, как упорядоченным движением электронов вдоль металлического провода, и в этом смысле электрон есть квант электричества.
6
Атом бора
Первая удачная попытка создания модели атома водорода, которая объяснила его наблюдаемый спектр, принадлежит Нильсу Бору (1913 г.). В конечном счете, Бор исходил из трех постулатов, которые можно сформулировать следующим образом:
Атомы могут пребывать только в определенных стационарных состояниях, в которых они не излучают и не поглощают энергии. В этих состояниях атомы обладают энергиями, образующими дискретный ряд:
Е1, Е2, Е3, Е4… (4)
Атомы могут излучать или поглощать энергию лишь при переходе из одного стационарного состояния в другое, причем частоты излучения (поглощения) определяются правилом:
 (5)
(5)
В стационарных состояниях электрон движется вокруг ядра по круговым орбитам, для которых момент импульса электрона принимает значения, кратные
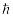 :
:
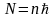 ,
n
= 1,2,3,4…
(6)
,
n
= 1,2,3,4…
(6)
где h и =h/2 – постоянные Планка.
По выражение самого Бора, "эти допущения находятся в явном противоречии с общепринятым пониманием электродинамики, но представляются необходимыми для экспериментально установленных фактов".
Если
учесть, что момент импульса по определению
 или просто N = mVr
для круговых орбит, то, используя третий
постулат, можно, найти радиусы разрешенных
орбит
или просто N = mVr
для круговых орбит, то, используя третий
постулат, можно, найти радиусы разрешенных
орбит
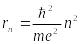 ,
(7)
,
(7)
где m – масса и e – заряд электрона.
Далее, имея в виду, что полная энергия атома как системы ядро-электрон связана с радиусом обращения электрона как E = –е2/2r, можно получить выражение для возможных значений энергий атома в стационарных состояниях:
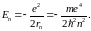 (8)
(8)
На рис. 2 графически изображены возможные значения энергии и соответствующие орбиты электронов в атоме водорода.
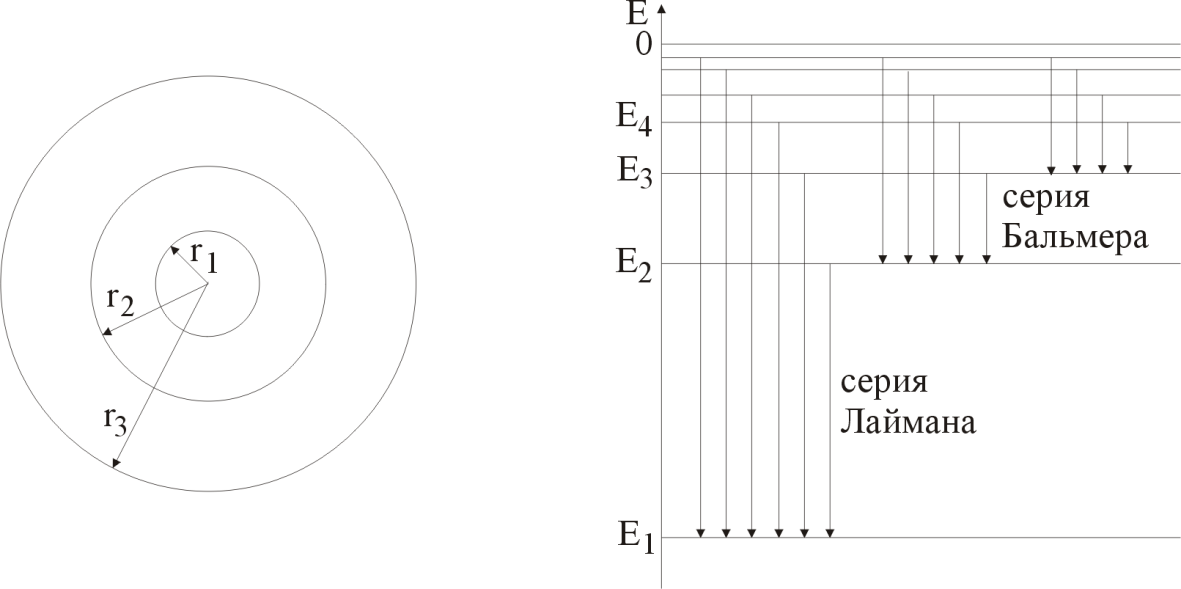
а) б)
Р и с. 2
Основному (невозбужденному) состоянию при n = 1 соответствуют:
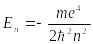 =
–13,6
эВ и
=
–13,6
эВ и 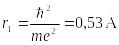
где r1 так называемый первый боровский радиус.
При возбуждении атомы переходят в состояния c большими значениями энергии и затем, при обратных переходах, которые изображены стрелками и сгруппированы определенным образом на рис. 2,б, излучают, согласно правилу частот (5), серии линий, изображенные на рисунке 1.
Аналитически частоты этих линий можно получить, комбинируя (5) и (8)
 (9)
(9)
С точностью до принятых обозначений (9) соответствует выражению (2), в котором с таким же успехом можно было принять n2 = nj и n1 = ni. Приравнивая коэффициенты перед скобками в (2) и (9), можно выразить постоянную Ридберга через универсальные константы и получить ее значение:
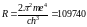 см-1,
см-1,
что поразительно хорошо согласуется с эмпирическим значением (3), Таким образом, выражения (2) и (9) совершенно эквивалентны, что свидетельствует о полном количественном соответствии теории Бора с экспериментом.
4Опыты Франка и Герца.

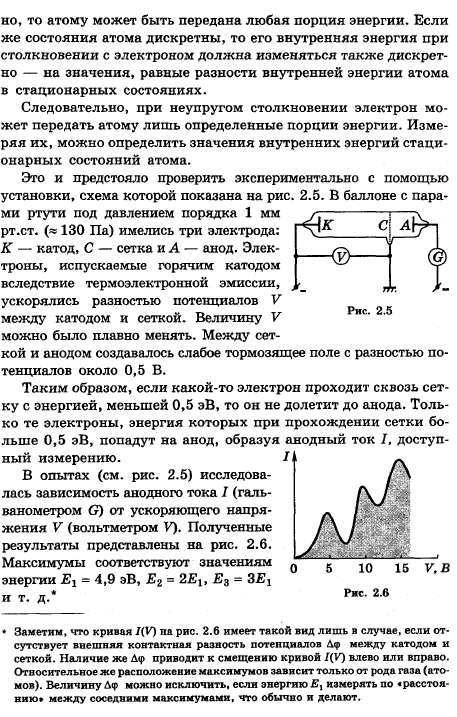
7
Эффект Комптона (Комптон-эффект) — явление изменения длины волны электромагнитного излучения вследствие упругого рассеивания егоэлектронами. Обнаружен американским физиком Артуром Комптоном в 1923 году для рентгеновского излучения. В 1927 Комптон получил за это открытие Нобелевскую премию по физике.

![]()
Иллюстрация к эффекту Комптона
При
рассеянии фотона на
покоящемся электроне частоты
фотона ![]() и
и ![]() (до
и после рассеяния соответственно)
связаны соотношением:
(до
и после рассеяния соответственно)
связаны соотношением:
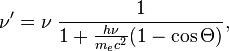
где ![]() —
угол рассеяния (угол между направлениями
распространения фотона до и после
рассеяния).
—
угол рассеяния (угол между направлениями
распространения фотона до и после
рассеяния).
Перейдя к длинам волн:
![]()
где ![]() — комптоновская
длина волны электрона.
— комптоновская
длина волны электрона.
Для электрона ![]() м.
Уменьшение энергии фотона после
комптоновского рассеяния
называется комптоновским
сдвигом.
В классической электродинамике рассеяние
электромагнитной волны на заряде
(томсоновское
рассеяние)
не сопровождается уменьшением её
частоты.
м.
Уменьшение энергии фотона после
комптоновского рассеяния
называется комптоновским
сдвигом.
В классической электродинамике рассеяние
электромагнитной волны на заряде
(томсоновское
рассеяние)
не сопровождается уменьшением её
частоты.
Объяснить эффект Комптона в рамках классической электродинамики невозможно. С точки зрения классической физики электромагнитная волнаявляется непрерывным объектом и в результате рассеяния на свободных электронах изменять свою длину волны не должна. Эффект Комптона является прямым доказательством квантования электромагнитной волны, другими словами подтверждает существование фотонов. Эффект Комптона является ещё одним доказательством справедливости корпускулярно-волнового дуализма микрочастиц.
Тормозное излучение — электромагнитное излучение, испускаемое заряженной частицей при её рассеянии (торможении) в электрическом поле. Иногда в понятие «тормозное излучение» включают также излучение релятивистских заряженных частиц, движущихся в макроскопических магнитных полях (в ускорителях, в космическом пространстве), и называют его магнитотормозным; однако более употребительным в этом случае является термин «синхротронное излучение»
Фото́н (от др.-греч. φῶς, род.
пад. φωτός,
«свет») — элементарная
частица, квант электромагнитного
излучения (в
узком смысле —света).
Это безмассовая
частица,
способная существовать только двигаясь
со скоростью
света. Электрический
заряд фотона
также равен
нулю.
Фотон может находиться только в двух
спиновых состояниях с проекцией спина на
направление движения (спиральностью)
±1. Этому свойству в классической
электродинамике соответствует
круговая правая и левая поляризация
электромагнитной волны.
Фотону как квантовой частице
свойственен корпускулярно-волновой
дуализм,
он проявляет одновременно свойства
частицы и волны.
Фотоны обозначаются буквой ![]() ,
поэтому их часто называют гамма-квантами (особенно
фотоны высоких энергий);
эти термины практическисинонимичны.
С точки зрения Стандартной
модели фотон
является калибровочным
бозоном. Виртуальные фотоны[5] являются
переносчиками электромагнитного
взаимодействия,
таким образом обеспечивая взаимодействие,
например, между двумя электрическими
зарядами.[6] Фотон —
самая распространённая по численности
частица во Вселенной. На один нуклон приходится
не менее 20 миллиардов фотонов.[7]
,
поэтому их часто называют гамма-квантами (особенно
фотоны высоких энергий);
эти термины практическисинонимичны.
С точки зрения Стандартной
модели фотон
является калибровочным
бозоном. Виртуальные фотоны[5] являются
переносчиками электромагнитного
взаимодействия,
таким образом обеспечивая взаимодействие,
например, между двумя электрическими
зарядами.[6] Фотон —
самая распространённая по численности
частица во Вселенной. На один нуклон приходится
не менее 20 миллиардов фотонов.[7]
