
- •Практична 3. Прості типи термодинамічних розрахунків. Поняття рівноваги. Рівноважний та нерівноважний стани системи
- •Локальна рівновага
- •Другий закон термодинаміки
- •Теплоємність
- •Хімічні реакції і вільна енергія Ґібса Константа рiвноваги реакцiї мiнералоутворення, її залежнiсть вiд температури I тиску.
- •Константа рівноваги
- •Зміна вільної енергії в хімічних реакціях
- •Зміна вільної енергії Гібса реакцій при зміні тиску
- •Розрахунок рівноваг для реакцій мінералоутворення у водних розчинах.
- •Основні рушійні сили геохімічних процесів
- •Принцип мінімізації вільної енергії – в стані рівноваги досягається мінімальна вільна енергія, можлива в цій системі. Люба мінеральна система прагне максимально зменшити свою вільну енергію.
Зміна вільної енергії Гібса реакцій при зміні тиску
Для реакций из участю реальних газів при перевищенні тиску над стандартним частка приросту вільної енергії, що залежить від тиску підраховується за рівнянням:
![]() (10)
(10)
де Vтв - об’ємний ефект реакції між твердими фазами; p -загальний тиск в системі; 0,1 - стандартний тиск в 0.1 МПа; n - зміна числа молів газу внаслідок реакції, знак залежить від того чи є газ продуктом реакції (плюс), чи вихідною речовиною (мінус); R - газова стала 8,3147 Дж/(К•моль); T - температура Кельвіна; fi - фугітивність газу (fi = Pi • i)
Для реакції із участю тільки конденсованих фаз приймається незмінність об'єму окремих фаз із підвищенням тиску. Тоді
![]() (11)
(11)
Зміна вільної енергії Ґібса системи внаслідок зміни температури і тиску визначається в два кроки:
Спочатку розраховується приріст вільної енергії реакції внаслідок зміни температури при стандартному тиску GT реакції;
Сумарний приріст вільної енергії рівняється
![]() (12)
(12)
Приклад:
Розрахуємо приріст вільної енергії Ґібса хімічної реакції утворення форстериту при скарнуванні доломіту
2CaMg(CO3) + SiO2 = Mg2[SiO4] + 2CaCO3 + 2CO2
при 300°С та fCO2=150 МПа.
1.Розрахуємо за рівняннями (3) і (8) G300°С кожної фази, що беруть участь в реакції
доломіт |
кварц |
форстерит |
Кальцит |
CO2 |
-2227786 |
-16527 |
-2095136 |
-1163416 |
-457258 |
2. Розрахуємо згідно рівняння реакції сумарне значення G300°С реагентів та G300°С продуктів реакції із врахуванням стехіометричних коефіцієнтів
G300°С реагентів = 2·G300°(доломіт)+ G300°(кварц)= -4472099
G300°С продуктів = G300°(форстерит)+ 2·G300°(кальцит) + 2·G300°(CO2)= -5336484
Розрахуємо G300°С реакції як різницю
G300°С реакції = G300°С продуктів - G300°С реагентів=
-5336484 – (-4472099) = -864385
Розрахуємо енергетичний ефект реакції в випадку якщо тиск системи створюється вуглекислим газом.
Згідно рівняння (10) спочатку необхідно вирахувати зміну об'єму твердих фаз внаслідок реакції
доломіт |
Кварц |
форстерит |
Кальцит |
CO2 |
64.34 |
22.688 |
43.79 |
36.934 |
|
43.79+2*36.934 –(2*64.34+22.688)= -33,71 см3 = -33,71 Дж/МПа
Тоді за рівнянням (10)
``= 2·8,3147·573,15·ln(10·150)Дж + (-33,71Дж/МПа·150МПа) = 64646,83 Дж
Загальна зміна вільної енергії в ході реакції складе
-864385 + 64646,83 = -799738,17
Якщо ми розрахували зміну вільної енергії Ґібса та об'ємний ефект реакції при даній температурі, тоді ми можемо оцінити загальний тиск в системі (знаючи парціальні тиски газів, що беруть участь в реакції) або ж парціальний тиск газу знаючи загальний тиск в системі.
Так, якщо в системі досягнута рівновага, то
член GT,P рівняння
дорівнює нулю GT,P = 0. Проігноруємо значення 0,1 МПа стандартного тиску, як зникомо мале в порівнянні із геологічно важливими тисками. Тоді отримаємо рівняння
0 = GT+Vтв·P±nRT·ln fi
В випадку твердофазової реакції
P =GTVтв
Результати розрахунків занесіть в таблицю вигляду
t,°C |
T,K |
GT |
P,МПа |
Vтв= |
|||
|
|
|
|
При участі в реакції газу його фугітивність рівняється
![]()
де 2,303 – перехідний коефіцієнт від натурального до десяткового логарифму.
![]()
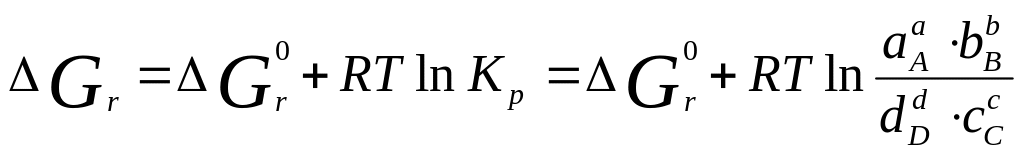
В умовах рiвноваги Gr = 0, тодi
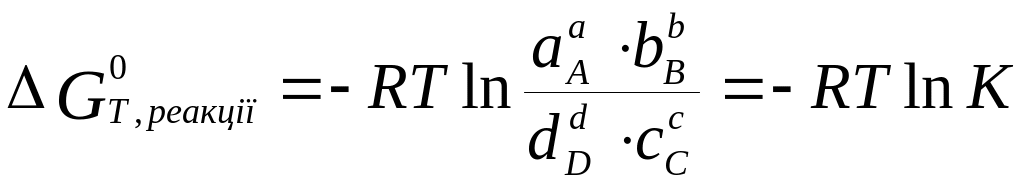
де K - константа рiвноваги реакцiї.
В умовах рівноваги константа реакції є постійною величиною при даних температурі та тиску.
![]()
![]()
При стандартному тиску 0,1 МПа рівняння набудуть вигляду
![]()
![]()
Використовуючи десятковi логарифми шляхом простих перетворень отримаємо для любих температур i тискiв
![]()
Умовно приймаючи V незалежним вiд температури i тиску, отримуємо
![]()
для любих температур i тиску 1 бар
![]()
Розрахувавши константу рiвноваги реакцiї ми можемо оцiнити вплив змiн активностей компонентiв системи на напрямок протiкання реакцiї мiнералоутворення
Розрахунок буферних реакцій. Константа рівноваги реакції Атв=Втв+Сгаз визначається рівнянням
![]()
звідси
![]()
В рівноважних умовах при постійних температурі і тиску фугітивність газу (константа рівноваги реакції) має чітко фіксоване значення.
Реакції, в ході яких фугітивність газової фази підтримується на постійному рівні називаються буферними.
Приклад.
Розрахувати
рівноважні фугітивності кисню для
реакції
![]() при різних температурах і тиску 1000 бар.
при різних температурах і тиску 1000 бар.
1. За табульованими значеннями ізобарних потенціалів гематиту, магнетиту і кисню розраховуєммо за рівнянням (16) значення ΔGТ реакції при різних температурах і тиску 1 бар. Знайдені значення ΔGТ реакції для різних температур записуються в табл
2.Розраховуємо
зміну об’єму твердих фаз для даної
реакції за рівнянням
![]() .
Кал/бар.
.
Кал/бар.
3.Оскільки
для цієї реакції
![]() ,
то
,
то
![]() Звідси за рівнянням (36) визначаємо
логарифми фугітивності кисню для реакції
при різних температурах і тиску 1000 бар.
Хід розрахунків зрозумілий з табл.
Звідси за рівнянням (36) визначаємо
логарифми фугітивності кисню для реакції
при різних температурах і тиску 1000 бар.
Хід розрахунків зрозумілий з табл.
4.
За даними табл. будуємо діаграму в
координатах
![]() (рис.)
лінія на якій відповідає багатоваріантній
рівновазі гематиту і магнетиту за
заданими значеннями загального тиску.
При збільшенні фугітивності кисню буде
стійка більш окислена фаза (гематит), а
нижче – більш відновлена фаза (магнетит).
(рис.)
лінія на якій відповідає багатоваріантній
рівновазі гематиту і магнетиту за
заданими значеннями загального тиску.
При збільшенні фугітивності кисню буде
стійка більш окислена фаза (гематит), а
нижче – більш відновлена фаза (магнетит).
Основний вплив на фугітивність кисню, який знаходиться в рівновазі з гематитом і магнетитом, здійснює температура. Останнє зумовлено малим об’ємним ефектом даної реакції.
Слід відмітити, що в подібних буферних реакціях фугітивність рівноважної газової фази не залежить від кількісного співвідношення твердих фаз.
