
- •Практична 3. Прості типи термодинамічних розрахунків. Поняття рівноваги. Рівноважний та нерівноважний стани системи
- •Локальна рівновага
- •Другий закон термодинаміки
- •Теплоємність
- •Хімічні реакції і вільна енергія Ґібса Константа рiвноваги реакцiї мiнералоутворення, її залежнiсть вiд температури I тиску.
- •Константа рівноваги
- •Зміна вільної енергії в хімічних реакціях
- •Зміна вільної енергії Гібса реакцій при зміні тиску
- •Розрахунок рівноваг для реакцій мінералоутворення у водних розчинах.
- •Основні рушійні сили геохімічних процесів
- •Принцип мінімізації вільної енергії – в стані рівноваги досягається мінімальна вільна енергія, можлива в цій системі. Люба мінеральна система прагне максимально зменшити свою вільну енергію.
Хімічні реакції і вільна енергія Ґібса Константа рiвноваги реакцiї мiнералоутворення, її залежнiсть вiд температури I тиску.
Для будь-якої реакції
aA + bB = cC + eE
коефіцієнт реакції згідно закону діючих мас можна записати співвідношення мас речовин, що приймають участь у реакції–

співвідношення добутку активностей продуктів реакції(взятих у ступіні, рівній стехіометричному коефіцієнту) до добутку активностей вихідних речовин (взятих у ступіні, рівній стехіометричному коефіцієнту).
Якщо в реакції досягається рівновага, тоді це співвідношення відповідає константі рівноваги для даних P-T умов.

Відповідно від типу реакції така константа рівноваги буде мати різні назви
Розчинення/ осадження KS = константа розчинності
Сорбція
Kd = коефіцієнт розподілу
Kx = селективний коефіцієнт
Руйнування/утворення комплексів
K= константа стабільності, константа комплектації
Окисно-відновні реакції
K= константа стабільності
Ця константа є оберненою: Крозчинення=1/Kосадження
Варто відмітити, що хіміки використовують вираз pK, що є негативним значенням logK, тобто -log K.
Коефіцієнт реакції Q рівний K тільки при досягненні рівноваги. Відповідно, визначення Q в експериментальній реакції є одним із шляхів визначення K.
Якщо Q менше K (або log Q/K < 0), реакція проходить зліва направо.
Якщо Q рівне K (або log Q/K = 0), реакція досягла рівноваги.
Якщо Q більше K (або log Q/K > 0) тоді реакція проходить справа наліво.
K змінюється залежно від температури T і тиску P для всіх реакцій, за винятком тих, що відбуваються за участю тільки газових компонентів (такі залежать тільки від температури).
Константа рівноваги може використовуватися для розрахунку невідомої рівноважної концентрації. Продемонструємо це на прикладі реакції розчинення флюориту
CaF2 = Ca2+ + 2F-
![]()
Kдис складає 3,9·10-11 . Тоді ми можемо розрахувати концентрацію іонів Ca2+ для рівноважних умов
![]()
Константа рівноваги
Для умов рівноваги реакції типу
mA + nB + .. = kC + lD + ..
Константа реакції K описується виразом
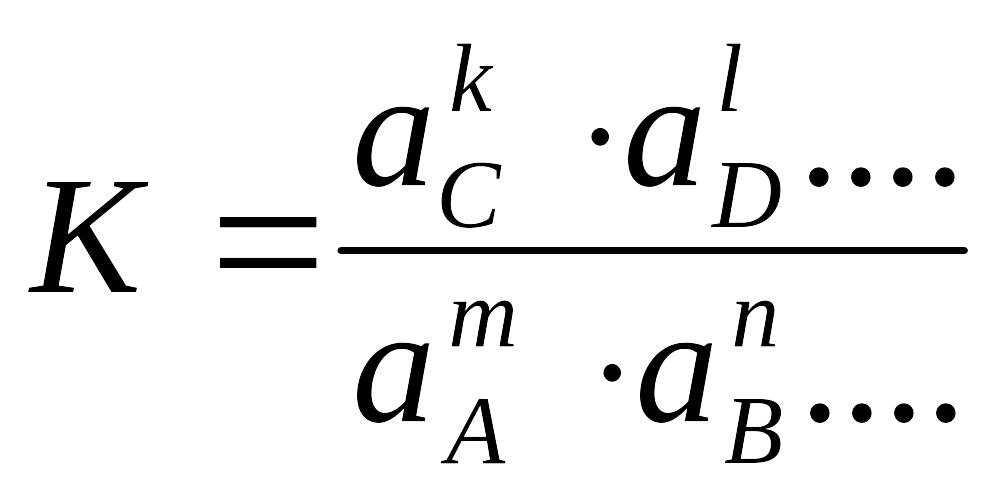
де a – активності реагентів та продуктів реакції.
Вільна енергія Ґібса реакції зв’язана із константою реакції виразом
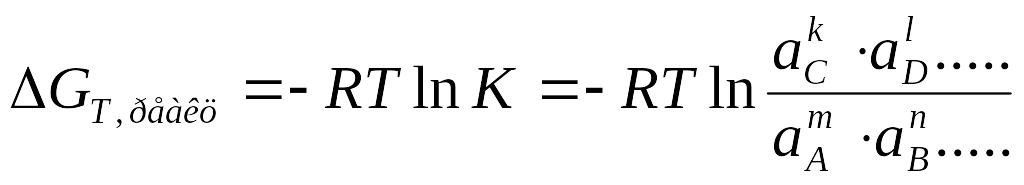
В умовах рівноваги константа реакції є постійною величиною при даних температурі та тиску.
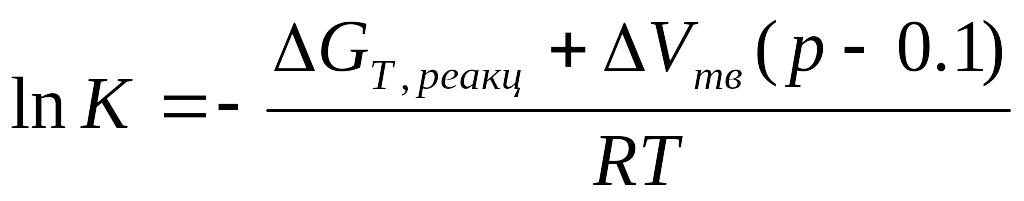
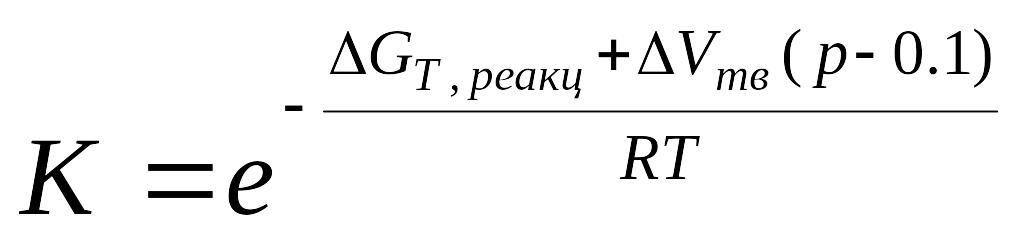
При стандартному тиску 0,1 МПа рівняння набудуть вигляду
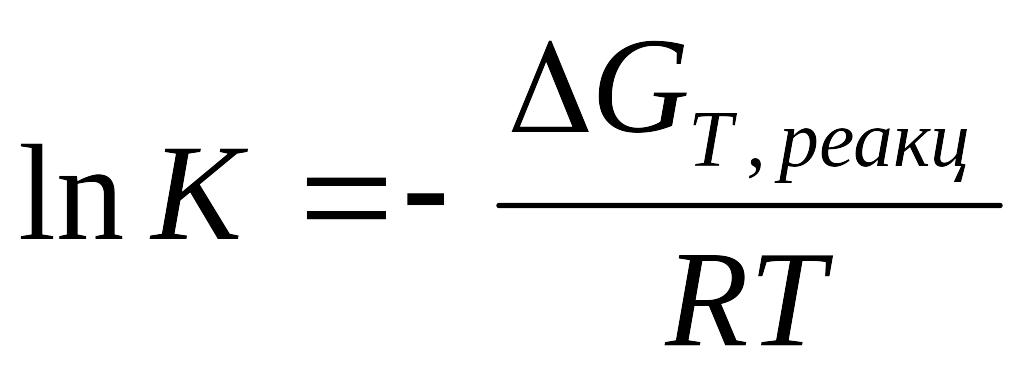
![]()
Використовуючи десяткові логарифми, для будь-якої температури і тиску 1 бар отримуємо
![]()
для для будь-якої температури і тиску
![]()
Умовно приймаючи Vнезалежним від температури і тиску отримуємо
![]()
Таким чином, знаючи значення приросту вільної енергії Ґібса реакції при даній температурі та стандартному тиску ми можемо легко розрахувати константу реакції.
Зміна вільної енергії в хімічних реакціях
Повна зміна вільної енергії системи визначається як змiною температури i тиску так i змiною хiмiчних потенцiалiв компонентiв системи
![]() (3.4)
(3.4)
Розрахувавши значення вільних енергій Гібса для потрібних температур для всіх компонентів системи, що беруть участь в реакції, ми можемо порахувати зміну вільної енергії Гібса системи в результаті реакції. В випадку, якщо участь беруть тільки тверді фази,
![]() (9)
(9)
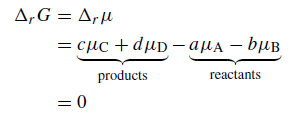
Вільна енергія реакції aA + bB = cC + eE розраховується за формулою
Gr = n•Gпродуктів - n •G вих.реч. = = c•G(C) + e•G(E) - a•DG(A) - b•DG(B)
Розглянемо реакцію розчинення кальциту
![]()
Якщо
![]()
то кальцит кристалізується і навпаки.
Так як значення
![]() і
і
![]() залежать
від концентрації (
залежать
від концентрації (![]() ),
кристалізація понижує обидва значення,
поки
),
кристалізація понижує обидва значення,
поки
![]()
тобто до досягнення рівноваги.
