
- •Практична 3. Прості типи термодинамічних розрахунків. Поняття рівноваги. Рівноважний та нерівноважний стани системи
- •Локальна рівновага
- •Другий закон термодинаміки
- •Теплоємність
- •Хімічні реакції і вільна енергія Ґібса Константа рiвноваги реакцiї мiнералоутворення, її залежнiсть вiд температури I тиску.
- •Константа рівноваги
- •Зміна вільної енергії в хімічних реакціях
- •Зміна вільної енергії Гібса реакцій при зміні тиску
- •Розрахунок рівноваг для реакцій мінералоутворення у водних розчинах.
- •Основні рушійні сили геохімічних процесів
- •Принцип мінімізації вільної енергії – в стані рівноваги досягається мінімальна вільна енергія, можлива в цій системі. Люба мінеральна система прагне максимально зменшити свою вільну енергію.
Практична 3. Прості типи термодинамічних розрахунків. Поняття рівноваги. Рівноважний та нерівноважний стани системи
Всяка система, позбавлена зовнішніх впливів, прямує до рівноваги.
Рівновага – це стан, коли ні один із параметрів системи не змінюється із часом і якщо насильно буде здійснена незначна зміна одного із параметрів системи, то цей параметр самовільно повернеться у початковий стан і система залишиться в стані рівноваги. Для того, щоб вивести систему із рівноваги потрібні значні збурення параметрів системи.
Для прикладу, стабільною, рівноважною формою H2O при +5°C є рідка вода, а при -5°C – лід (рис. 3.4б). Перебіг замерзання (кристалізація) і плавлення H2O відбувається швидко і однозначно залежно від напрямку зміни температури, супроводжуючись збільшенням маси фази із меншою вільною енергією і зменшенням маси більш енерго-ємнісної фази.
Ми говоримо, що система знаходиться в стані рівноваги, якщо всі її параметри не змінюються з часом. Це визначення включає в себе також стан метастабільної рівноваги.
Локальна рівновага
Природні процеси нерівноважні, динамічні і протікають за участю потоків речовини та енергії, тобто у відкритих системах. Досягнення рівноваги для усієї відкритої системи може бути нереальним, але стан окремих, дуже малих частин системи може наближатися або ж досягати рівноваги. Тоді ми говоримо, що окремі області системи знаходяться в стані локальної рівноваги і термодинаміка може бути застосована для цих невеликих ділянок.
Водний розчин, рухаючись у порах вапняку, спричинює розчинення кальциту – система нерівноважна. Поряд із цим, в таких системах ми будемо спостерігати ріст кристалів кальциту чи утворення кірок та сталактитів. Тобто іони кальцію та карбонату в розчині знаходяться недалеко від рівноваги і існуючі в системі коливання параметрів стану можуть спричинювати виникнення на певних ділянках умов, коли швидкості розчинення та кристалізації кальциту урівняються, тобто у цих ділянках встановиться локальна рівновага. У цьому випадку термодинаміка може бути використана для ілюстрації процесу взаємодії ненасиченого розчину із кальцитовою породою.
Інші системи можуть мати градієнти температури чи складу і, в цілому, бути нерівноважними. В локальних, дуже малих ділянках такої системи градієнти стають настільки малими, що ними можна нехтувати і термодинаміки застосовується для цих малих ділянок локальної рівноваги.
Термодинамічний процес - всяка зміна системи, пов'язана із змінами хоча б одного параметра.
Процес
адіабатичний(ΔQ = 0, без зміни кількості теплоти в системі)
ізотермічний (ΔT = 0)
ізобаричний (ΔP = 0)
ізохорний (ΔV = 0)
Будь-які зміни можуть здійснюватись тільки в результаті перерозподілу енергії.
Стан системи називається рівноважним, якщо в системі пройшли всі макроскопічні процеси і встановилась рівність всіх інтенсивних параметрів.
Нульовий закон термодинаміки стверджує, що дві системи в рівновазі мають одну і ту ж температуру
При переході системи із одного стану в інше зміна її властивостей не залежить від шляху переходу, а визначається тільки початковим і кінцевим його станом, тобто термодинамічними параметрами в цих станах.
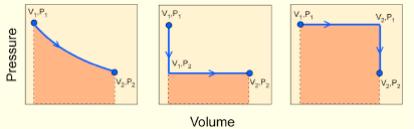
Рис. 3.7. Схема, що ілюструє незалежність полведінки термодинамічної системи від шляху.
Термодинамічні параметри системи свідчать тільки про його теперішній стан, ніяк не свідчить про його попередні стани. Це твердження дозволяє використовувати термодинаміку для реконструкції попередніх станів геохімічних систем.
Перший закон термодинаміки стверджує, що зміна енергії системи рівняється кількості енергії, отриманій системою із навколишнього середовища на протязі певного проміжку часу (Пригожин, Дефай, 1954). Енергія не виникає сама по собі, зміна її кількості у хімічній системі зумовлена обміном енергією між системою та навколишнім середовищем.
У відповідності із цим енергія ізольованої системи постійна. Саме для ізольованої системи сформульований принцип збереження енергії.
Температура, тиск і об’єм системи є взаємозв’язаними параметрами.
Виберемо як систему певний об’єм, який містить n молів газу. В такій системі встановлюється співвідношення:
|
P- тиск, V- об’єм, v – кількість моль, R – газова стала (8,31Дж/моль-К), T – температура (К, T = t(ºC) + 273.15).
Це закон ідеального газу – зміна теплоти в системі призведе до зміни або тиску, або ж об’єму системи, і навпаки – зміна тиску чи об’єму спричинює зміну температури (при постійному складі системи).
Для закритої системи, що обмінюється із середовищем енергією у вигляді тепла Q та механічної роботи W справедливе наступне формулювання першого закону термодинаміки
Q = U + A (3.1),
- кількість теплоти Q, отримана системою внаслідок процесу за певний проміжок часу реалізована через зміну внутрішньої енергії U системи та роботу A, здійснену середовищем над системою (або системою над середовищем. Тепло, енергія та робота виражаються в джоулях (Дж).
Для ізобаричного процесу, тобто в умовах постійного тиску P
Q = U2-U1 + P(V2-V1) QP = U2+P·V2 - (U1+P·V1) = H2-H1 = H |
де
![]() –
ентальпія, що рівняється величині
внутрішньої енергії системи складеної
із добутком об’єму і тиску.
–
ентальпія, що рівняється величині
внутрішньої енергії системи складеної
із добутком об’єму і тиску.
Фізичний зміст ентальпії: різниця ентальпій в двох станах рівняється тепловому ефекту ізобарного процесу.
Якщо ми розглядаємо хімічну реакцію, то різниця сумарної ентальпії продуктів і сумарної ентальпії вихідних речовин є тепловим ефектом реакції.
Якщо H реакції > 0, то реакція екзотермічна, якщо H реакції < 0, то реакція ендотермічна.
Одиниці вимірювання ентальпії джоуль/моль (кДж/моль = Дж/моль·1000). Раніше використовувалась величина кал/моль: 1 кал/моль = 4.1840 Дж.
Для ізохорного процесу, що відбувається при незмінному об’ємі V
QV = U |
Експериментально неможливо встановити абсолютне значення внутрішньої енергії, так як неможливо перевести систему в стан, позбавлений енергії. Можна встановити тільки її зміну. Тому в термодинамічних розрахунках користуються порівнянням енергії системи до вибраного дослідниками нульового стану. В хімічній термодинаміці за нульовий стан приймається стан речовини, що складається із ізольованих, невзаємодіючих атомів при нульовій температурі Кельвіна. Це є наслідком другого і третього законів термодинаміки.
