
- •5. Основні положення мкт речовини та експериментальне їх підтвердження
- •2. Термодинамічний і статистичний підходи до вивчення макроскопічних систем.
- •4.Температурні шкали. Зв'язок між ними.
- •9. Ізопроцеси. Закони Бойля-Маріотта. Закон Шарля.
- •8. Рівняння стану ідеального газу:вивід, аналіз і межі застосування.
- •6. Основне рівняння мкт
- •22. Вакуум. Властивості розрідженого газу.
- •19. Дифузія газів. Рівняння Фіка.
- •20. Внутрішнє тертя в газах.
- •13. Барометрична формула. Зміна концентрації молекул газу з висотою.
- •14. Розподіли Больцмана, Максвела-Больцмана,їх аналіз
- •26.Перший закон термодинаміки.
- •28.Застосування 1 закону термодинаміки до ізобарного процесу
- •29.Застосування 1 закону до ізотермічного та ізохорного процесів
- •30.Адіабатний процес.Рівняння Пуассона
- •34.Цикл карно.Ккд циклу
- •36.Другий закон термодинаміки.Теорема карно
- •38.Ентропія системи.Статистичне тлумачення 2 закону термодинаміки
- •39.Постулат Больцмана.Статистичне тлумачення 2 закону термодинаміки
- •43.Рівняння Ван-дер-Вальса.Вирази до поправок р і б.
- •44.Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
- •48.Внутрішня енергія реального газу
- •53.Теплопровідність твердих тіл
- •56.Поняття фази.Крива фазової рівноваги
- •60.Діаграма стану речовини.Потрійна точка
- •1.Предмет і методи дослідження молекулярної фізики
- •11.Розподіл швидкостей молекул за Максвелом
- •15.Досліди Перрена з визначення числа Авогадро
- •24.Внутрішня енергія термодинамічної системи
- •27.Теплоємність ідеальних газів.Вивести рівняння майєра
30.Адіабатний процес.Рівняння Пуассона
Адіабатним процесом називається такий процес, який відбувається без теплообміну термодинамічної системи з навколишнім середовищем (Q12 = 0). Розглянемо адіабатний процес: (1) (2), Q12 = 0, Р1,V1,Т1 V2, Р2,Т2. Перший закон термодинаміки для адіабатного процесу має вигляд:
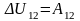
 ,
або
,
або
 .
Тобто в адіабатному процесі робота
виконується газом за рахунок зміни його
внутрішньої енергії: якщо газ адіабатно
розширюється, його робота додатна A12>0,
внутрішня енергія зменшується U12<0
і газ охолоджується Т2<Т1,
якщо ж газ адіабатно стискається A13<0
(
.
Тобто в адіабатному процесі робота
виконується газом за рахунок зміни його
внутрішньої енергії: якщо газ адіабатно
розширюється, його робота додатна A12>0,
внутрішня енергія зменшується U12<0
і газ охолоджується Т2<Т1,
якщо ж газ адіабатно стискається A13<0
(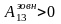 ),
його внутрішня енергія і температура
зростають U13>0,
Т3>Т1
(рис. 2.18).
Робота
газу в адіабатному процесі знаходиться
з виразу:
=
–СVT
=
),
його внутрішня енергія і температура
зростають U13>0,
Т3>Т1
(рис. 2.18).
Робота
газу в адіабатному процесі знаходиться
з виразу:
=
–СVT
=
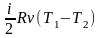 .Теплоємність
в адіабатному процесі: CQ=
CтQ=0
=
.Теплоємність
в адіабатному процесі: CQ=
CтQ=0
=
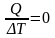 .
Рівняння адіабатного процесу: PV = const,
або
.
Рівняння адіабатного процесу: PV = const,
або
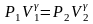 .
Цей вираз називають рівнянням
Пуассона.
Тут
.
Цей вираз називають рівнянням
Пуассона.
Тут
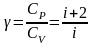 – показник адіабати, або
коефіцієнт
Пуассона,
який залежить від виду газу. Оскільки
1,
то крива залежності P(V)V-
у випадку адіабатного процесу
спадає
крутіше, ніж у випадку ізотермічного
процесу P(V)V-1
(рис. 2.18).
Інший вигляд рівняння адіабати можна
отримати, використавши рівняння
Менделєєва–Клапейрона й виразивши
з нього тиск через об’єм і температуру
або об’єм через тиск і температуру:
– показник адіабати, або
коефіцієнт
Пуассона,
який залежить від виду газу. Оскільки
1,
то крива залежності P(V)V-
у випадку адіабатного процесу
спадає
крутіше, ніж у випадку ізотермічного
процесу P(V)V-1
(рис. 2.18).
Інший вигляд рівняння адіабати можна
отримати, використавши рівняння
Менделєєва–Клапейрона й виразивши
з нього тиск через об’єм і температуру
або об’єм через тиск і температуру: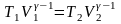 або
або
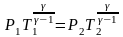 .
.
33.Оборотні
і необоротні цикли.Прямі і зворотні
цикли 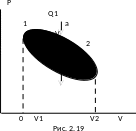 У
термодинаміці важливе значення мають
такі процеси, коли термодинамічна
система після проходження ряду станів
повертається до початкового стану
(P1,V1,T1)(P2,V2,T2).
Такі
процеси називаються коловими
процесами
або циклами.
У
термодинаміці важливе значення мають
такі процеси, коли термодинамічна
система після проходження ряду станів
повертається до початкового стану
(P1,V1,T1)(P2,V2,T2).
Такі
процеси називаються коловими
процесами
або циклами.
На
діаграмі (рис. 2.19) зображений цикл, у
якому спочатку на ділянці (1)(а)(2)
газу надається кількість теплоти
Q12 = Q1,
газ розширюється і виконує додатну
роботу А12.
Потім зовнішні сили стискають газ на
ділянці (2)(b)(1),
виконуючи роботу
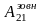 ,
і від газу забирається кількість теплоти
Q21 = –Q2.
Робота газу на цій ділянці від’ємна
,
і від газу забирається кількість теплоти
Q21 = –Q2.
Робота газу на цій ділянці від’ємна
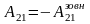 ,
причому
,
причому
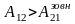 .
Такий цикл, який виконується за
годинниковою стрілкою, називається
прямим
циклом.
Сумарна робота газу в даному циклі
додатна А121
=
А12
+ А21
0 й дорівнює площі заштрихованої фігури.
Я
.
Такий цикл, який виконується за
годинниковою стрілкою, називається
прямим
циклом.
Сумарна робота газу в даному циклі
додатна А121
=
А12
+ А21
0 й дорівнює площі заштрихованої фігури.
Я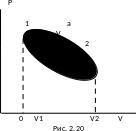 кщо
здійснити цикл проти годинникової
стрілки, то робота буде та сама за
абсолютною величиною, але від’ємна
оскільки робота розширення газу на
ділянці (1)(b)(2)
менша, ніж робота зовнішніх сил стискання
газу на ділянці (2)(а)(1).
Такий процес називається зворотним
циклом.
Застосуємо
перший закон термодинаміки до прямого
циклу, що використовується у теплових
двигунах: Q121 = U121 + A121,
або Q121 = A121,
оскільки U121 =
U(121)
= 0 і робота, що виконується за один цикл,
дорівнює сумарній підведеній теплоті.
Цю теплоту можна знайти як:
Q121 = Q12 + Q21 =
Q1
–
Q2,
де Q1
– кількість
теплоти, що надається газу при його
розширенні; Q2
–
кількість
теплоти, що віддається газом при його
стисканні.Звідси, корисна робота циклу
A
= A121
=
Q1
–
Q2,
і термічний коефіцієнт корисної дії
(ККД) для прямого циклу, що визначається
відношенням корисної роботи, виконаної
газом, до енергії у формі теплоти, яку
він отримав від зовнішніх джерел,
дорівнює:
кщо
здійснити цикл проти годинникової
стрілки, то робота буде та сама за
абсолютною величиною, але від’ємна
оскільки робота розширення газу на
ділянці (1)(b)(2)
менша, ніж робота зовнішніх сил стискання
газу на ділянці (2)(а)(1).
Такий процес називається зворотним
циклом.
Застосуємо
перший закон термодинаміки до прямого
циклу, що використовується у теплових
двигунах: Q121 = U121 + A121,
або Q121 = A121,
оскільки U121 =
U(121)
= 0 і робота, що виконується за один цикл,
дорівнює сумарній підведеній теплоті.
Цю теплоту можна знайти як:
Q121 = Q12 + Q21 =
Q1
–
Q2,
де Q1
– кількість
теплоти, що надається газу при його
розширенні; Q2
–
кількість
теплоти, що віддається газом при його
стисканні.Звідси, корисна робота циклу
A
= A121
=
Q1
–
Q2,
і термічний коефіцієнт корисної дії
(ККД) для прямого циклу, що визначається
відношенням корисної роботи, виконаної
газом, до енергії у формі теплоти, яку
він отримав від зовнішніх джерел,
дорівнює: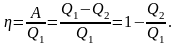 Важливим
поняттям у термодинаміці є поняття
оборотного
термодинамічного процесу.
Термодинамічний
процес називається оборотним,
якщо він може проходити як у прямому
напрямку, так й у зворотному через ті
самі проміжні стани, без змін в
навколишньому середовищі. Необоротним
називається процес,
коли зворотний перехід через ті самі
проміжні стани неможливий. Оборотні
процеси – це ідеалізація реальних
процесів. Усі реальні процеси є
необоротними.
Важливим
поняттям у термодинаміці є поняття
оборотного
термодинамічного процесу.
Термодинамічний
процес називається оборотним,
якщо він може проходити як у прямому
напрямку, так й у зворотному через ті
самі проміжні стани, без змін в
навколишньому середовищі. Необоротним
називається процес,
коли зворотний перехід через ті самі
проміжні стани неможливий. Оборотні
процеси – це ідеалізація реальних
процесів. Усі реальні процеси є
необоротними.
