
- •5. Основні положення мкт речовини та експериментальне їх підтвердження
- •2. Термодинамічний і статистичний підходи до вивчення макроскопічних систем.
- •4.Температурні шкали. Зв'язок між ними.
- •9. Ізопроцеси. Закони Бойля-Маріотта. Закон Шарля.
- •8. Рівняння стану ідеального газу:вивід, аналіз і межі застосування.
- •6. Основне рівняння мкт
- •22. Вакуум. Властивості розрідженого газу.
- •19. Дифузія газів. Рівняння Фіка.
- •20. Внутрішнє тертя в газах.
- •13. Барометрична формула. Зміна концентрації молекул газу з висотою.
- •14. Розподіли Больцмана, Максвела-Больцмана,їх аналіз
- •26.Перший закон термодинаміки.
- •28.Застосування 1 закону термодинаміки до ізобарного процесу
- •29.Застосування 1 закону до ізотермічного та ізохорного процесів
- •30.Адіабатний процес.Рівняння Пуассона
- •34.Цикл карно.Ккд циклу
- •36.Другий закон термодинаміки.Теорема карно
- •38.Ентропія системи.Статистичне тлумачення 2 закону термодинаміки
- •39.Постулат Больцмана.Статистичне тлумачення 2 закону термодинаміки
- •43.Рівняння Ван-дер-Вальса.Вирази до поправок р і б.
- •44.Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
- •48.Внутрішня енергія реального газу
- •53.Теплопровідність твердих тіл
- •56.Поняття фази.Крива фазової рівноваги
- •60.Діаграма стану речовини.Потрійна точка
- •1.Предмет і методи дослідження молекулярної фізики
- •11.Розподіл швидкостей молекул за Максвелом
- •15.Досліди Перрена з визначення числа Авогадро
- •24.Внутрішня енергія термодинамічної системи
- •27.Теплоємність ідеальних газів.Вивести рівняння майєра
6. Основне рівняння мкт
Розглянемо
одноатомний ідеальний газ, молекули
якого рухаються хаотично, зіткнення
молекул зі стінками посудини абсолютно
пружні, а концентрація газу дорівнює
п.
Відокремимо на стінці посудини деяку
площинку площиною S
й
обчислимо тиск, що діє на цю площинку
(рис. 2.4). За час ∆t
площинки
досягнуть тільки ті молекули, які
рухаються у напрямку осі 0х
і містяться в об'ємі V
циліндра з основою
S і
висотою υ∆t.
Число цих молекул позначимо Nx.
Для визначення їхнього числа зазначимо,
що згідно з теорією ймовірності у
будь-який момент часу вздовж кожної осі
з трьох вимірів (Ох,
Oy, Oz)
рухається 1/3
від кількості всіх молекул N=nV,
причому половина молекул рухається
вздовж напрямку осі, а половина – у
протилежному. Тобто число співударів
з площинкою буде дорівнювати
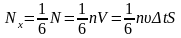 .При
пружному зіткненні з площинкою одна
молекула передає їй імпульс р,
який дорівнює зміні імпульсу молекули
після
зіткнення рх
=
mo
– (-mo)=
2mo.
Тоді за другим законом Ньютона визначаємо
силу тиску на площинку:
.При
пружному зіткненні з площинкою одна
молекула передає їй імпульс р,
який дорівнює зміні імпульсу молекули
після
зіткнення рх
=
mo
– (-mo)=
2mo.
Тоді за другим законом Ньютона визначаємо
силу тиску на площинку:
 ,
а
далі й тиск на площинку:
,
а
далі й тиск на площинку:
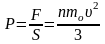 .
.
З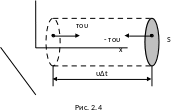 азначимо,
що у даному випадку
– це середня квадратична швидкість,
яка визначається із співвідношення:
азначимо,
що у даному випадку
– це середня квадратична швидкість,
яка визначається із співвідношення:
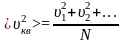 ,де
N
– загальна кількість молекул.
,де
N
– загальна кількість молекул.
Тоді
у результаті маємо тиск газу: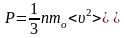 .
.
Це рівняння називається основним рівнянням молекулярно-кінетичної теорії ідеального газу.
22. Вакуум. Властивості розрідженого газу.
Поняття вакууму залежить від співвідношення між довжиною вільного пробігу молекул і розмірами посудини, де знаходиться даний газ. Стан газу, коли середня довжина вільного пробігу <l > порівнянна з розмірами посудини L, у якій знаходиться газ, називається вакуумом: <l >~L. Оскільки при незмінній температурі T=const довжина вільного пробігу обернено пропорційна тиску: <l> ~ 1/n ~ 1/P, говорячи про вакуум наводять відповідні значення тиску.
Розрізняють такі ступені вакууму:
1.низький
вакуум – <l
>
 L,
тиск 102105 Па;
L,
тиск 102105 Па;
2.середній вакуум – <l > L, тиск 10-1 102 Па;
3високий вакуум – <l > >L, тиск 10-6 10-1 Па;
4надвисокий вакуум – <l > >>L, тиск менший за 110-6 Па.
Для створення вакууму різного ступеня розрідження застосовуються вакуумні насоси. Щоб одержати високий вакуум, спочатку необхідно створити попереднє розрідження (форвакуум) за допомогою механічного форвакуумного насоса. Для одержання високого вакууму застосовуються високовакуумні дифузійні та турбомолекулярні насоси, які не здатні відкачувати газ із посудини, починаючи з атмосферного тиску, тому їх використовують разом із форвакуумними насосами. Оскільки при надвисокому вакуумі у стані ультрарозрідження молекули практично одна з одною не зіштовхуються, то у газу в цьому стані відсутнє внутрішнє тертя. Відсутність зіткнень між молекулами розрідженого газу відображається також на механізмі теплопровідності. Явище зменшення теплопровідності вакууму при зниженні тиску використовується на практиці для створення теплової ізоляції. Прикладом є термос, а також посудина Дьюара, де теплоізоляцією слугує подвійна скляна стінка посудини. Між стінками знаходиться сильно розріджене повітря, теплопровідність якого дуже мала. Посудини Дьюара використовують для зберігання рідин, що киплять при низьких температурах, таких як скраплені кисень, азот, водень, гелій.
