
- •5. Основні положення мкт речовини та експериментальне їх підтвердження
- •2. Термодинамічний і статистичний підходи до вивчення макроскопічних систем.
- •4.Температурні шкали. Зв'язок між ними.
- •9. Ізопроцеси. Закони Бойля-Маріотта. Закон Шарля.
- •8. Рівняння стану ідеального газу:вивід, аналіз і межі застосування.
- •6. Основне рівняння мкт
- •22. Вакуум. Властивості розрідженого газу.
- •19. Дифузія газів. Рівняння Фіка.
- •20. Внутрішнє тертя в газах.
- •13. Барометрична формула. Зміна концентрації молекул газу з висотою.
- •14. Розподіли Больцмана, Максвела-Больцмана,їх аналіз
- •26.Перший закон термодинаміки.
- •28.Застосування 1 закону термодинаміки до ізобарного процесу
- •29.Застосування 1 закону до ізотермічного та ізохорного процесів
- •30.Адіабатний процес.Рівняння Пуассона
- •34.Цикл карно.Ккд циклу
- •36.Другий закон термодинаміки.Теорема карно
- •38.Ентропія системи.Статистичне тлумачення 2 закону термодинаміки
- •39.Постулат Больцмана.Статистичне тлумачення 2 закону термодинаміки
- •43.Рівняння Ван-дер-Вальса.Вирази до поправок р і б.
- •44.Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
- •48.Внутрішня енергія реального газу
- •53.Теплопровідність твердих тіл
- •56.Поняття фази.Крива фазової рівноваги
- •60.Діаграма стану речовини.Потрійна точка
- •1.Предмет і методи дослідження молекулярної фізики
- •11.Розподіл швидкостей молекул за Максвелом
- •15.Досліди Перрена з визначення числа Авогадро
- •24.Внутрішня енергія термодинамічної системи
- •27.Теплоємність ідеальних газів.Вивести рівняння майєра
1.Предмет і методи дослідження молекулярної фізики
Будову та внутрішній рух тіл та систем, що складаються з дуже великої кількості складових елементів (атомів, молекул, елементарних часток, інших тіл, навіть зірок та інших небесних тіл - молекул в подальшому) вивчають два взаємодоповнюючих розділи фізики: молекулярна фізика та термодинаміка. Предмет їх дослідження носить назву термодинамічної системи. Дослідження термодинамічних систем відбувається принципово різними методами, які взаємно доповнюють один одного.
11.Розподіл швидкостей молекул за Максвелом
Розглядається
рівноважний
стан ідеального газу,
що не знаходиться під дією зовнішніх
сил. Параметри стану, в тому числі і
концентрація
молекул у всіх точках системи однакові.
Рух
молекул абсолютно хаотичний, всі напрямки
руху молекул абсолютно рівноправні,
проекції швидкостей руху молекул
незалежні одна від одної.
Після встановлення рівноважного
хаотичного руху процесами взаємного
зіткнення молекул можна нехтувати.
Останнє положення Максвелом приймалось
на віру і було обґрунтоване теоретично
пізніше Л.Больцманом. Виходячи з таких
положень Максвел, використовуючи методи
математичної статистики, отримав функції
розподілу молекул за проекціями
швидкостей:
 (6.10)
де
(6.10)
де
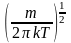 є
нормуючий
коефіцієнт.
Виходячи
з положення про незалежність проекцій
швидкостей, та з положення теорії
ймовірностей про множення ймовірностей
випадкових величин (6.3), отримаємо функцію
розподілу молекул за швидкостями (тобто
густину ймовірності мати конкретне
значення вектора швидкості, або одночасно
мати всі три проекції швидкості):
є
нормуючий
коефіцієнт.
Виходячи
з положення про незалежність проекцій
швидкостей, та з положення теорії
ймовірностей про множення ймовірностей
випадкових величин (6.3), отримаємо функцію
розподілу молекул за швидкостями (тобто
густину ймовірності мати конкретне
значення вектора швидкості, або одночасно
мати всі три проекції швидкості):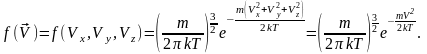
15.Досліди Перрена з визначення числа Авогадро
Використання
барометричної формули дало можливість
французькому досліднику Жану Батисту
Перену в 1909 році експериментально
визначити число Авогадро. В дослідах
Перена вивчався розподіл концентрації
дрібнодисперсних часток смоли гумігуту
в воді. Тому що використовувались не
молекули а частинки значно більших
розмірів, замість маси необхідно було
брати до уваги ефективну масу з врахуванням
виштовхувальної сили
 ,
де ,
0
відповідно густина речовини гумігуту
і води, а
– діаметр частинок. Таким чином
,
де ,
0
відповідно густина речовини гумігуту
і води, а
– діаметр частинок. Таким чином

Звідки
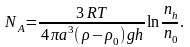
Концентрація
часток в шарах емульсії та відстань між
ними h
вимірювалась
за допомогою мікроскопа. В дослідах
Перена змінювались температура та
розмір зерен частинок емульсії. У всіх
дослідах значення постійної Авогадро
отримано близьким до 6,8·1023
моль-1,
що непогано співпадає з сучасним
значенням цієї константи. Якщо зважити
на те що mgh
= Еп
–
потенціальна енергія молекул повітря
в полі сили тяжіння, то барометричну
формулу (6.22) можна переписати у вигляді,
що дає розподіл молекул у потенціальному
полі: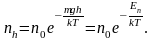
24.Внутрішня енергія термодинамічної системи
Молекулярна
фізика дає тлумачення внутрішньої
енергії
як суми кінетичних енергій всіх молекул
та потенціальної енергії їх взаємодії.
В подальшому розглядаються тільки такі
процеси, в яких не відбувається перетворень
молекул, атомів або їх ядер. Енергія, як
завжди, визначається з точністю до
адитивної константи, тому всі види
енергії вказаних джерел вводяться в
константу, яка приймається нульовою.
Внутрішня енергія ідеальних газів
складається тільки з кінетичної енергії
руху молекул і дорівнює

В термодинаміці внутрішню енергію частіше позначають літерою U, тому приймемо його. Кількість теплоти та робота відповідно позначаються літерами Q та A.
