
- •5. Основні положення мкт речовини та експериментальне їх підтвердження
- •2. Термодинамічний і статистичний підходи до вивчення макроскопічних систем.
- •4.Температурні шкали. Зв'язок між ними.
- •9. Ізопроцеси. Закони Бойля-Маріотта. Закон Шарля.
- •8. Рівняння стану ідеального газу:вивід, аналіз і межі застосування.
- •6. Основне рівняння мкт
- •22. Вакуум. Властивості розрідженого газу.
- •19. Дифузія газів. Рівняння Фіка.
- •20. Внутрішнє тертя в газах.
- •13. Барометрична формула. Зміна концентрації молекул газу з висотою.
- •14. Розподіли Больцмана, Максвела-Больцмана,їх аналіз
- •26.Перший закон термодинаміки.
- •28.Застосування 1 закону термодинаміки до ізобарного процесу
- •29.Застосування 1 закону до ізотермічного та ізохорного процесів
- •30.Адіабатний процес.Рівняння Пуассона
- •34.Цикл карно.Ккд циклу
- •36.Другий закон термодинаміки.Теорема карно
- •38.Ентропія системи.Статистичне тлумачення 2 закону термодинаміки
- •39.Постулат Больцмана.Статистичне тлумачення 2 закону термодинаміки
- •43.Рівняння Ван-дер-Вальса.Вирази до поправок р і б.
- •44.Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
- •48.Внутрішня енергія реального газу
- •53.Теплопровідність твердих тіл
- •56.Поняття фази.Крива фазової рівноваги
- •60.Діаграма стану речовини.Потрійна точка
- •1.Предмет і методи дослідження молекулярної фізики
- •11.Розподіл швидкостей молекул за Максвелом
- •15.Досліди Перрена з визначення числа Авогадро
- •24.Внутрішня енергія термодинамічної системи
- •27.Теплоємність ідеальних газів.Вивести рівняння майєра
44.Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
З
рівняння Менделєєва–Клапейрона
виходить, що при Т = const
і m = const
залишається постійним добуток PV = const,
тобто це ізотермічний закон Бойля-Маріотта,
звідки P=const/V
. З рівняння Ван-дер-Ваальса випливає
більш складна залежність P = f(V)
при постійній температурі: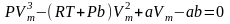 .
Отримане
рівняння є алгебраїчним рівнянням
третього степеня відносно молярного
об’єму. Існує критична
температура
Тк:
при T>Тк
ізотерми реального газу майже не
відрізняються від ізотерм ідеального
газу, при T<Тк
є область станів, де ізотерма має
хвилеподібну ділянку і кожному значенню
тиску відповідають три точки ізотерми.
При підвищенні температури ці точки
зближуються і при T=Тк
зливаються в одну точку К, яка є точкою
перегину ізотерми при T=Тк.
При
підвищенні температури до критичної
Т = Тк
отримуємо критичну
ізотерму
без хвилеподібних ділянок. При цій
температурі зникає різниця між
газоподібним і рідким станом речовини.
Відповідні тиск Рк
і молярний об’єм Vmк
також називаються критичними, а стан з
критичними параметрами речовини Рк,
Vmк,
Тк
називається критичним
станом.
Критичні параметри Рк,
Vmк,
Тк
можна знайти з рівняння Ван-дер-Ваальса
через сталі a
i
b:
.
Отримане
рівняння є алгебраїчним рівнянням
третього степеня відносно молярного
об’єму. Існує критична
температура
Тк:
при T>Тк
ізотерми реального газу майже не
відрізняються від ізотерм ідеального
газу, при T<Тк
є область станів, де ізотерма має
хвилеподібну ділянку і кожному значенню
тиску відповідають три точки ізотерми.
При підвищенні температури ці точки
зближуються і при T=Тк
зливаються в одну точку К, яка є точкою
перегину ізотерми при T=Тк.
При
підвищенні температури до критичної
Т = Тк
отримуємо критичну
ізотерму
без хвилеподібних ділянок. При цій
температурі зникає різниця між
газоподібним і рідким станом речовини.
Відповідні тиск Рк
і молярний об’єм Vmк
також називаються критичними, а стан з
критичними параметрами речовини Рк,
Vmк,
Тк
називається критичним
станом.
Критичні параметри Рк,
Vmк,
Тк
можна знайти з рівняння Ван-дер-Ваальса
через сталі a
i
b:
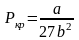 ,
,
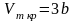 ,
,
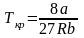 .
.
Пара відрізняється від інших газоподібних станів тим, що при ізотермічному стисканні відбувається процес зрідження. А газ, який знаходиться при температурі вищій за критичну T>Тк, не може бути перетворений стисканням на рідину.
48.Внутрішня енергія реального газу
Внутрішня
енергія реального газу U
складається
з кінетичної енергії теплового руху
його молекул (визначає внутрішню енергію
ідеального газу, що дорівнює Uк
= CVT
для
одного моля) і потенціальної енергії
міжмолекулярної взаємодіїUn
. Потенціальна енергія реального газу
зумовлена лише силами притягання між
молекулами, які приводять до виникнення
внутрішнього тиску на газ
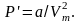 Робота,
яка витрачається для подолання сил
притягання, що діють між молекулами
газу, іде на збільшення потенціальної
енергії системи, тобто
Робота,
яка витрачається для подолання сил
притягання, що діють між молекулами
газу, іде на збільшення потенціальної
енергії системи, тобто
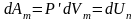 або
або
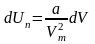 .
Звідси
знаходимо потенціальну енергію одного
моля реального газу:
.
Звідси
знаходимо потенціальну енергію одного
моля реального газу:
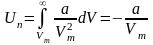 .
Знак
"-" означає, що молекулярні сили,
які створюють внутрішній тиск, є силами
притягання.
Тоді повна внутрішня енергія одного
моля реального газу дорівнює
.
Знак
"-" означає, що молекулярні сили,
які створюють внутрішній тиск, є силами
притягання.
Тоді повна внутрішня енергія одного
моля реального газу дорівнює
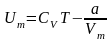 .
.
Вона
зростає зі збільшенням температури й
об’єму газу.Якщо газ розширюється без
теплообміну з навколишнім середовищем
і не виконує роботу, то на підставі
першого закону термодинаміки одержимо,
що
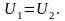 Отже,
при адіабатичному розширенні без
здійснення зовнішньої роботи внутрішня
енергія газу не змінюється. Для ідеального
газу це означає, що при адіабатному
розширенні у вакуум (тобто без виконання
роботи) його температура не змінюється
Т1 = Т2.
Для
реального газу, з огляду на те, що для
одного моля газу
Отже,
при адіабатичному розширенні без
здійснення зовнішньої роботи внутрішня
енергія газу не змінюється. Для ідеального
газу це означає, що при адіабатному
розширенні у вакуум (тобто без виконання
роботи) його температура не змінюється
Т1 = Т2.
Для
реального газу, з огляду на те, що для
одного моля газу
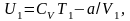
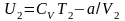 ,
одержуємо
,
одержуємо
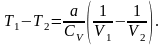 Оскільки
V2
> V1
,
то
T1
>T2,
тобто реальний газ при адіабатному
розширенні у вакуум охолоджується.
Оскільки
V2
> V1
,
то
T1
>T2,
тобто реальний газ при адіабатному
розширенні у вакуум охолоджується.
53.Теплопровідність твердих тіл
Знайдемо внутрішню енергію одного моля твердого тіла, яке має атомну кристалічну решітку, у вузлах якої знаходяться атоми, що коливаються відносно свого рівноважного положення. Внутрішня енергія дорівнює сумі енергій частинок, що утворюють кристалічну решітку. Частинки мають як кінетичну, так і потенціальну енергію, які в середньому дорівнюють одна одній. На одну ступінь вільності молекули, згідно із законом Больцмана (див. п.2.2.1), припадає у середньому кінетична енергія, що дорівнює kT/2. Таким чином, на одну коливальну ступінь вільності припадає енергія kT. Оскільки частинка може коливатися відносно положення своєї рівноваги у будь-якому напрямку, звідси випливає, що вона має три ступені вільності (і = 3). Тому значення повної середньої енергії атома о = 3kT.
З урахуванням вищевикладеного внутрішня енергія одного моля атомарного кристала дорівнює Um = оNA = 3kTNA = 3RT. З іншого боку, оскільки об’єм твердого тіла величина стала, Um = СV T.
Звідси:
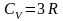 ,
тобто молярна теплоємність усіх хімічно
простих кристалічних тіл однакова. Ця
залежність називається законом
Дюлонга і Пті.
Вона була експериментально встановлена
цими вченими 1819 р.
,
тобто молярна теплоємність усіх хімічно
простих кристалічних тіл однакова. Ця
залежність називається законом
Дюлонга і Пті.
Вона була експериментально встановлена
цими вченими 1819 р.
Для
хімічно складних тіл молярна теплоємність
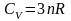 (де
п
– число атомів у молекулі).
(де
п
– число атомів у молекулі).
Експерименти показують, що закон Дюлонга і Пті виконується тільки за досить високої температури (Т300 К), а навіть за кімнатної температури має наближений характер. Зі зниженням температури теплоємність усіх твердих кристалічних тіл зменшується СV T 3 і в міру наближення до абсолютного нуля прямує до нуля. Поведінка теплоємності за низьких температур була пояснена Ейнштейном і Дебаєм, виходячи з квантової теорії.
