
- •5. Основні положення мкт речовини та експериментальне їх підтвердження
- •2. Термодинамічний і статистичний підходи до вивчення макроскопічних систем.
- •4.Температурні шкали. Зв'язок між ними.
- •9. Ізопроцеси. Закони Бойля-Маріотта. Закон Шарля.
- •8. Рівняння стану ідеального газу:вивід, аналіз і межі застосування.
- •6. Основне рівняння мкт
- •22. Вакуум. Властивості розрідженого газу.
- •19. Дифузія газів. Рівняння Фіка.
- •20. Внутрішнє тертя в газах.
- •13. Барометрична формула. Зміна концентрації молекул газу з висотою.
- •14. Розподіли Больцмана, Максвела-Больцмана,їх аналіз
- •26.Перший закон термодинаміки.
- •28.Застосування 1 закону термодинаміки до ізобарного процесу
- •29.Застосування 1 закону до ізотермічного та ізохорного процесів
- •30.Адіабатний процес.Рівняння Пуассона
- •34.Цикл карно.Ккд циклу
- •36.Другий закон термодинаміки.Теорема карно
- •38.Ентропія системи.Статистичне тлумачення 2 закону термодинаміки
- •39.Постулат Больцмана.Статистичне тлумачення 2 закону термодинаміки
- •43.Рівняння Ван-дер-Вальса.Вирази до поправок р і б.
- •44.Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
- •48.Внутрішня енергія реального газу
- •53.Теплопровідність твердих тіл
- •56.Поняття фази.Крива фазової рівноваги
- •60.Діаграма стану речовини.Потрійна точка
- •1.Предмет і методи дослідження молекулярної фізики
- •11.Розподіл швидкостей молекул за Максвелом
- •15.Досліди Перрена з визначення числа Авогадро
- •24.Внутрішня енергія термодинамічної системи
- •27.Теплоємність ідеальних газів.Вивести рівняння майєра
5. Основні положення мкт речовини та експериментальне їх підтвердження
Основні положення молекулярно-кінетичної теорії (МКТ) такі:
усі тіла складаються з мікрочастинок – молекул і атомів;
молекули й атоми речовини завжди знаходяться у стані безперервного хаотичного теплового руху;
між частинками будь-якої речовини існують сили взаємодії – притягання і відштовхування – електромагнітної природи.
Молекулами називаються найменші частинки речовини, які зберігають її хімічні властивості. Молекула, у свою чергу, побудована з одного або декількох атомів одного чи різних хімічних елементів. Розмір молекули й атома d~10-10 м.
Основні положення МКТ підтверджуються явищами броунівського руху частинок, дифузії, особливостями будови і різницею властивостей газів, рідин, твердих тіл та іншими явищами. Дослідні дані, які лежать в основі МКТ, наочно доводять молекулярну будову речовини, наявність молекулярного руху і залежності цього руху від температури. Для пояснення теплових процесів, які безпосередньо пов’язані з будовою речовини, необхідно встановити закони, які описують зміни, що відбуваються з тілами під дією теплоти.
2. Термодинамічний і статистичний підходи до вивчення макроскопічних систем.
Оскільки молекулярно-кінетичні уявлення засновані на тому, що будь-яке макроскопічне тіло побудоване з величезної кількості молекул, які знаходяться у безперервному хаотичному русі, методи механіки непридатні для опису теплових явищ, зумовлених спільним рухом цих молекул. Тому для опису руху цієї величезної кількості молекул, щоб отримати макроскопічні властивості речовини, використовується статистичний метод, заснований на застосуванні методів теорії ймовірності та математичної статистики до конкретних моделей будови тіл, що вивчаються. Цей метод і лежить в основі молекулярної фізики.
Термодинаміка, на відміну від молекулярної фізики, вивчає макроскопічні характеристики речовини, не використовуючи в явному вигляді уявлення про її молекулярну будову. Термодинамічний метод дослідження фізичних властивостей речовини заснований на аналізі переходу енергії з одного виду в іншій у фізичних процесах, які відбуваються з макроскопічними тілами. При цьому термодинаміка спирається на два основні закони (перший і другий закони термодинаміки), які встановлені дослідним шляхом. Термодинамічний метод використовують для аналізу загальних закономірностей у різноманітних теплових явищах. Термодинаміка як розділ фізики виникла у ХІХ столітті у зв’язку з потребами теплотехніки після винаходу парового двигуна, а потім парової турбіни й двигуна внутрішнього згоряння.
Молекулярна фізика і термодинаміка, відрізняючись у методах, взаємно доповнюють одна одну, тому й вивчаються разом як завершені та сформовані розділи класичної фізики.
3.Параметри
системи. Фізичний зміст та вимірювання.Система
макроскопічних тіл, які взаємодіють
між собою та навколишнім середовищем,
обмінюючись, зокрема, енергією, називається
термодинамічною
системою.
Стан
системи характеризується макроскопічними
фізичними величинами, які називаються
термодинамічними
параметрами стану.
До основних параметрів стану належать,
насамперед, тиск Р,
об’єм V,
термодинамічна температура Т,
густина речовини ,
молярна маса М.
Тиском називається величина нормальної
складової сили, що діє на одиницю площі
поверхні, до якої ця сила прикладена:
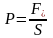 .
Температура
– це характеристика системи, яка
знаходиться у стані термодинамічної
рівноваги, тобто температура має бути
однаковою у всіх тіл, що входять до
системи. Рівномірна температурна шкала
звичайно побудована на двох реперних
точках відліку, різниці між якими надають
визначене значення.
Густина
– це маса одиниці об’єму речовини:
.
Температура
– це характеристика системи, яка
знаходиться у стані термодинамічної
рівноваги, тобто температура має бути
однаковою у всіх тіл, що входять до
системи. Рівномірна температурна шкала
звичайно побудована на двох реперних
точках відліку, різниці між якими надають
визначене значення.
Густина
– це маса одиниці об’єму речовини:
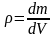 .
1
моль речовини – це одиниця її кількості,
яка містить стільки ж структурних
частинок, скільки атомів міститься у
0,012 кг вуглецю (точніше,
його ізотопу
.
1
моль речовини – це одиниця її кількості,
яка містить стільки ж структурних
частинок, скільки атомів міститься у
0,012 кг вуглецю (точніше,
його ізотопу
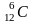 ).
Це – число Авогадро – NА
= 6,021023
1/моль. Молярна маса речовини – маса
одного моля – знаходиться за формулою:
).
Це – число Авогадро – NА
= 6,021023
1/моль. Молярна маса речовини – маса
одного моля – знаходиться за формулою:
М = (А1 n1 +А2 n2 +…)10-3 кг/моль, де А1 , А2 , … – відносні атомні маси хімічних елементів, з яких побудована молекула;
n1, n2, … – кількість відповідних атомів у молекулі.
Тоді
кількість речовини у молях визначається
за формулою:
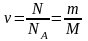 .
.
Найважливіші параметри стану P, V, T пов’язані між собою рівнянням f (P, V,T) = 0, яке називається рівнянням стану.
