
Преобразование Лоренца.

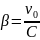
Связь между .
Связь между
 .
.
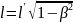 .
.
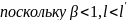 ,
размер движущегося тела сокращается
относительно К в направлении движения.
,
размер движущегося тела сокращается
относительно К в направлении движения.Парадокс близнецов.
Закон сложения скоростей в ТО.
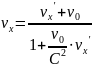
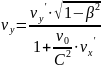
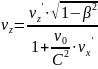
Сложить 2с и 3с. Наверное 5с…Нет просто С... Выше скорости света не судьба.
2 вида массы в ТО:
Масса покоя (m0) m неподвижного тела.
Релятивистская – m движущегося тела.
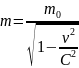
Релятивистский импульс:
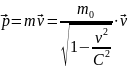
3 вида энергии в ТО.
Энергия покоя.
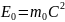
Полная энергия.

Кинетическая энергия.

Связь между Е и р

Связь между Т и р
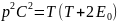
Суть статистического подхода – с помощью закона механики изучается движение 1 выделенной молекулы, результаты усредняются по всем молекулам, таким образом, появляются коллективные параметры, описывающие всю систему сразу.
Суть термодинамического подхода – движение 1 молекулы не изучается, сразу вводятся коллективные параметры (p, V, T) с помощью общих законов природы устанавливаются различные связи между коллективными параметрами.
Идеальный газ – модель газа, удовлетворяющая условиям:
а) Собственный объем молекул намного меньше объема сосуда (молекулы – точки без объема).
б) Энергия взаимодействия между молекулами намного меньше, энергии движения.
в) Столкновение молекул между собой, и со стенками внутри сосуда, считаются абсолют. упругими (без потери).
Закон Бойля-Мариотта

Закон Гей-Люссака

Закон Шарля
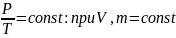
Закон Авогадро: при постоянных давлениях и температуре, 1 моль газа занимает постоянный объем. 1 моль – количество газа, взятое в граммах равное молекулярному числу из т. Менделеева.
Молекулярное число – отношение массы некоторого газа к 1/12 массы атома углерода.
Число Авогадро
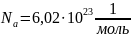 – фиксированное число молекул в 1 моле
любого газа.
– фиксированное число молекул в 1 моле
любого газа.
Нормальные условия: T=273K=0
 С,
P=105Па.
При нормальных условиях, 1 моль любого
газа занимает
С,
P=105Па.
При нормальных условиях, 1 моль любого
газа занимает
22,4*10-3
 .
.

Закон Дальтона
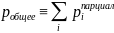 – если в сосуде
имеется смесь из различных газов, то
общее давление равно сумме парциальных.
– если в сосуде
имеется смесь из различных газов, то
общее давление равно сумме парциальных.
Парциальное давление - давление отдельно взятого компонента газовой смеси.
Уравнение Клапейрона -
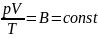
Универсальная газовая постоянная –
 .
.
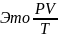 при нормальных условиях.
при нормальных условиях.Уравнение состояния идеального газа

Постоянная Больцмана.
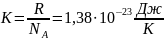
Простая форма уравнения состояния идеального газа.
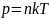
Основное уравнение МКТ

Формула для

Средняя энергия поступательного движения одной молекулы.

Функция Максвелла.
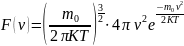
Формула для
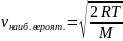 .
.Формула для

Соотношение между н.в. : : ср.кв. = 1 : 1,13 : 1,22
Барометрическая формула

Распределение Больцмана

Внутренняя энергия газа – суммарная кинетическая энергия всех молекул + потенциальная энергия взаимодействий между ними. В идеальном газе энергией взаимодействия пренебрегают, поэтому там останется только кинетическая энергия всех молекул.
3 группы газов:
Одноатомные.
2-х атомные + многоатомные линейные, все атомы на одной линии(O2,N2,CO2).
Многоатомные не линейные(H2O, NH3).
3 вида движения молекулы:
Поступательное. Центр масс молекулы как одна точка движется в пространстве поступательно.
Вращательное. Вся молекула как одно целое вращается на месте, к примеру относительно осей x, y, z.
Колебательные. Атомы внутри молекулы колеблются около своих положений равновесия.
Число степеней свободы – это количество независимых координат однозначно задающих положение молекулы в пространстве. Если молекула состоит из N атомов, то общее число степеней свободы будет 3N.
На поступательное движение всегда 3 степени свободы.
Число вращательных степеней зависит от группы молекул: Для I – 0 степеней. Для II – 2 степени. И для III группы 3 вращения относительно x,y,z.
Все остальные степени свободы колебательные.
Средняя энергия 1-ой молекулы
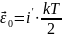
Внутренняя энергия идеального газа

I закон термодинамики:
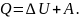 Он
представляет закон сохранения энергии
в тепловых процессах, когда идет
охлаждение или нагревание газа.
Он
представляет закон сохранения энергии
в тепловых процессах, когда идет
охлаждение или нагревание газа.Формула для Aизоб, Aизот и Aизох.
Aизоб
(p = const)

Aизот
(t
= const)
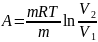
Aизоx
(V = const)
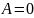
2 вида теплоемкости, связь между ними:
Удельная:

Молярная:
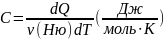
Связь:

Формулы для Сv и Сp.


Уравнение Майера.

Формула для
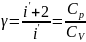
Значения
 для 3 групп молекул:
для 3 групп молекул:
1
группа:
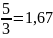
2
группа:

3
группа:
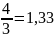
Адиабатический процесс – процесс, при котором отсутствует теплообмен между газом и окружающей средой. Любой быстро протекающий процесс, можно считать адиабатическим.
I закон т/д для адиабатического процесса:
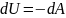
Уравнение Пуассона.
 ,
,

Формула для
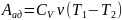
Связь между р и Т

Связь между V и Т
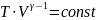
Вторая формула для
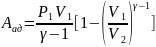
Круговой процесс – когда газ, проходя ряд промежуточных состояний возвращается в исходное состояние.
Прямой и обратный круговые процессы – если обход замкнутого контура проходит по часовой стрелке, то круговой процесс называется прямым, используется в тепловых двигателях A>0. Если обход против часовой, то круговой процесс называется обратным. Используется в холодильных машинах A<0.
I закон т/д для кругового процесса.
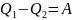
К
 ПД
кругового процесса
ПД
кругового процесса
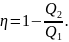
Схема тепловой машины.
Обратимый и необратимый процессы. Обратимый процесс идет в обоих направлениях, необратимый только в одном.
Цикл Карно и его график. Пример обратимого кругового процесса. Он состоит из 2-х изотерм и 2-х адиабат. График имеет вид:

КПД цикла Карно.
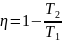 T1
– температура нагревателя, Т2
– температура холодильника.
T1
– температура нагревателя, Т2
– температура холодильника.Энтропия – ф-я состояния газа. Малое значение которой опред. по формуле:

Формула для
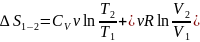

Неравенство Клаузиуса. Для кругового процесса
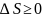 .
.
Формула Больцмана для энтропии.

Термодинамическая вероятность (W) – число микросостояний, из которого построено одно макросостояние.
II закон термодинамики: все реальные процессы(не обратимые) идут с возрастанием энтропии, полный хаос в газе(равномерное распределение) имеет макс. энтропию, поэтому иногда говорят, что энтропия это мера беспорядков в системе.
Элементарный заряд – наименьший по величине заряд.
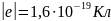
Носители элементарного заряда – электрон |-e|, протон |+e|
Закон сохранения зарядов – в замкнутой системе при любых процессах, общий заряд системе сохраняется.
Точечные заряды – 2 заряда называются точечными, когда размеры носителей этих зарядов намного меньше расстояния между ними.
Закон Кулона в вакууме:
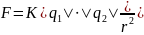

Электрическая постоянная
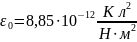 :
:
Напряженность поля
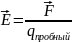
Е для одного заряда
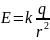 .
.
Силовая линия – это некоторая кривая, в общем случае, касательная которой дают направление
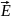 в заданной точке.
в заданной точке.Принцип суперпозиции полей.
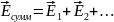
Малый поток

Теорема ОГ. Поток вектора
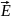 через произв. замкнут. поверхность S
равен:
через произв. замкнут. поверхность S
равен:
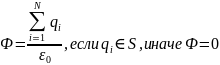
Е для одной плоскости:

Е для двух плоскостей:
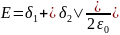
Модель конденсатора
Е для сферы.

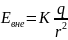
Е для шара.
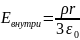
Е для цилиндра.
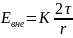
Работа эл./ст. поля

Циркуляция вектора . Это

