
- •1 Вопрос. Основные понятия термодинамики.
- •3 Вопрос внутр. Энергия и энтальпия.
- •4 Вопрос. Работа изменения объема рабочего тела.
- •5 Вопрос. 1-й з-н термодинамики.
- •6 Вопрос. Ур-е состояния ид. Газа.
- •7 Вопрос. Основные з-ны ид. Газов .
- •8 Вопрос. Смеси идеальных газов.
- •9 Вопрос. Теплоемкости идеальных газов.
- •10 Вопрос. Изохорным
- •11. Изотермический
- •12. Изобарный
- •13. Адиабатный
- •14. Политропный
- •15 Вопрос. Термодинамич. Обратимость процессов.
- •16 Вопрос. Оценка эффективности циклов.
- •17 Вопрос. Осн. Формулировки 2-го з-на термодинамики.
- •18 Вопрос. Цикл карно.
- •19 Вопрос. Энтропия и ее изм. В обратных процессах.
- •20 Вопрос. Ts-диаграмма идеального газа
- •21 Вопрос. Регенеративный цикл
- •22 Вопрос. Среднеинтегральня температура
- •23 Вопрос. Изменение энтропии в необратимых процессах
- •24 Вопрос. Физич смысл энтропии.
- •25 Вопрос. Аналитич выражение 2-го з-на термодинамики.
- •26 Вопрос Термические коэффициенты
- •28 Вопрос Теория ассоциации и уравнения состояния реальных газов
14. Политропный
Политропными называются процессы, в которых теплоемкость имеет любое, но постоянное на протяжении всего процесса значение. Очевидно, это определение означает, что в любом политропном процессе распределение подводимой теплоты между изменением внутренней энергии и работой газа,
Так, при n = 0 уравнение политропы принимает вид p = const, т. е. превращается в уравнение изобары. Следовательно, изобара представляет собой политропу с n = 0.
Аналогично этому легко показать, что изотерма - это политропа с показателем n = 1, а адиабата - это политропа с показателем n = k.
Согласно определению политропного процесса изохора также является политропой, поскольку для нее с = с3 = const.
в зависимости от показателя политропы теплоемкость газа в политпропных процессах может иметь различные значения, что наглядно иллюстрируется графиком с = f (n), приведенным на рис. 4.5.
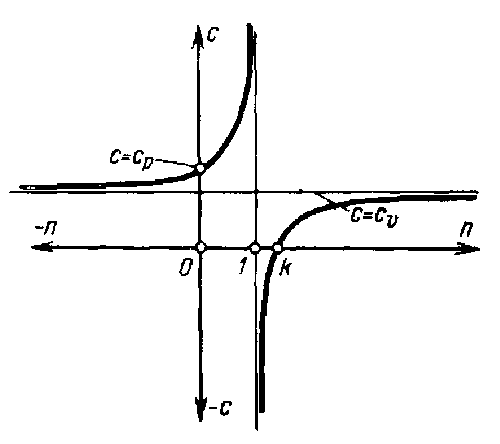
В частности, для изохорного процесса, когда n = ±00, с = с3; для изобарного процесса, когда n = 0, c = cp; для изотермического процесса, когда n = 1, c = ±0; наконец, для адиабатного процесса, когда n = k, c = 0.
, для того чтобы уста-
Рис. 4.6
новить, является ли политропным процесс, изображенный в pu-диаграмме какой-либо линией, следует несколько точек этой линии перенести в логарифмическую систему координат.
15 Вопрос. Термодинамич. Обратимость процессов.
Термодинамически обратимыми называются процессы изменения состояния рабочего тела, которые могут быть проведены в обратном направлении таким образом, что и само рабочее тело, и окружающая среда пройдут через те же промежуточные состояния, что и в прямом направлении, но лишь в обратной последовательности. В противном случае процессы являются термодинамически необратимыми.
Для того, чтобы процесс был обратимым, необходимо соблюсти два условия: во-первых, в каждый данный момент рабочее тело должно находиться в равновесном состоянии, т. е. процесс должен быть равновесным; во-вторых, разность температур при любом теплообмене между рабочим телом и внешним источником теплоты должна быть в каждый данный момент бесконечно малой.
Если не соблюдено первое условие, то процесс является внутренне необратимым; если не соблюдено второе условие, то он является внешне необратимым.
Для того, чтобы два условия обратимости были соблюдены, процесс должен протекать с бесконечно малой скоростью, и если температура рабочего тела в ходе процесса изменяется, то необходимо наличие бесконечно большого числа источников теплоты с бесконечно близкими температурами и рабочее тело должно проходить в соприкосновение последовательно с каждым из них. Поэтому естественно, что понятие об обратимых процессах является научной абстракцией и все реальные процессы необратимы.
16 Вопрос. Оценка эффективности циклов.
В ыше
было показано, что термодинамические
циклы бывают прямыми и обратными. В
прямых циклах теплота превращается в
работу, а в обратных - работа превращается
в теплоту.
ыше
было показано, что термодинамические
циклы бывают прямыми и обратными. В
прямых циклах теплота превращается в
работу, а в обратных - работа превращается
в теплоту.
в
Рассмотрим условия, которые необходимо соблюсти для осуществления прямого цикла (рис. 5.1). Известно, что процесс, расположенный
ыше адиабаты, проходящей через его начальную точку, протекает с подводом теплоты, а ниже ее - с отводом теплоты. Поэтому, проведя две адиабаты, касательные к линии прямого цикла в точках А и В, мы получаем два участка этой линии - верхний и нижний. На верхнем участке процесс сопровождается подводом теплоты, а на нижнем - отводом ее. Следовательно, для осуществления такого цикла необходимо бесконечно большое количество горячих источников теплоты, отдающих рабочему телу теплоту в количестве q1 при бесконечно малой разности температур и бесконечно большое количество холодных теплоприемников, получающих от рабочего тела теплоту в количестве q2 также при бесконечно малой разности температур. Разность этих количеств тепла q0 = q1 - q2 расходуется на совершение работы /0 , равной площади, ограниченной линией цикла, причем по первому закону термодинамики q0 = /0.Прямые обратимые циклы являются идеализацией комплекса реальных процессов, осуществляемых в тепловых двигателях с целью превращения теплоты в работу. Поэтому характеристикой эффективности таких циклов является отношение
показывающее, какая доля всей затраченной на цикл теплоты превращается в работу. Это отношение называется термическим коэффициентом полезного действия (КПД) данного цикла.
Изложенное показывает, что превращение теплоты в работу не является процессом самопроизвольным и может быть осуществлено лишь при наличии компенсирующего процесса - передачи части затрачиваемого тепла из горячих в холодные теплоприемники без превращения в работу.
А налогичным
образом можно выяснить условия
осуществления обратных циклов (рис.
5.2).
налогичным
образом можно выяснить условия
осуществления обратных циклов (рис.
5.2).
Две адиабаты, касательные к линии обратного цикла в точках С и D, делят весь цикл на два участка - нижний, на котором теплота подводится в количестве q2 от бесконечно большого числа холодных источников теплоты, и верхний, на котором теплота отводится в количестве q1 к бесконечно большому числу горячих теплоприемников. Разность этих количеств теплоты q0 = q1 - q2 представляет собой теплота, полученная за счет затраты работы, равной площади цикла, причем по первому закону термодинамики q0 = /0.
Обратные обратимые циклы являются идеализацией комплексов реальных процессов, осуществляемых в холодильных установках с целью переноса теплоты с более низкого на более высокий температурный уровень. Поэтому характеристикой эффективности таких циклов является отношение
показывающее, какое количество теплоты, отводимого от холодных источников, приходится на единицу затраченной работы. Это отношение называется холодильным коэффициентом.
Изложенное показывает, что переход теплоты с более низкого на более высокий температурный уровень не является процессом самопроизвольным и может быть осуществлен при наличии компенсирующего процесса - превращения определенного количества работы в теплоту, передаваемой затем горячим теплоприемникам вместе с теплотой, отнимаемой у холодильных источников теплоты.
