
Вопрос 3.
Основным катодным процессом является восстановление ионов металла, которое в упрощенном виде может быть выражено уравнением:
Меⁿ+ +ne→Ме (1)
В действительности, восстановление происходит по более сложному механизму. Как правило, катионы Ме находятся в водном растворе в виде комплексов, например:
Электролит |
Аммиакатный |
Кислый сульфатный |
Щелочной цианистый |
Комплексы Ме |
[Cu(NH3)4]²+ |
[Cu(OH2)4]²+ |
[Cu(CN)2]ˉ |
В процессе разряда комплексного иона он постепенно теряет свои лиганды и также присоединяет электроны. Как правило, это происходит ступенчато и скорость определяющей стадии является самой медленной.
Процесс электроосаждения включает ряд стадий:
диффузия ионов к поверхности;
передача электронов (восстановление);
адсорбция атома на поверхности;
встраивание атома в кристаллическую решетку;
отвод лигандов от поверхности.
Стадии переноса заряда и адсорбция атома на поверхности могут меняться местами. Соответственно, различают различные составляющие перенапряжения осаждения металла – диффузионное перенапряжение, перенапряжение кристаллизации и т.д. Перенапряжение кристаллизации играет большую роль в образовании структуры осадка. Малое его значение ведет к образованию крупнокристаллических осадков, большое – к мелкокристаллическим.
В случае осаждения металла переменной валентности на катоде может происходить частичное восстановление ионов металла.
В гальванотехнике используются 2 типа анодов – растворимые и нерастворимые.
Растворимый анод изготовлен из осаждаемого металла. На аноде протекает процесс его растворения.
Этот процесс пополняет электролит ионами осаждаемого металла. В случае равенства выходов по току катодного и анодного процессов ванна стабильна по балансу ионов металла.
Нерастворимый анод (малорастворимый, инертный). Нерастворимые аноды изготавливаются из свинца, графита, платины, платинированного титана, ОРТА (окисно-рутениевый титановый анод).
В этом случае основной реакцией, протекающей на аноде, является реакция окисления воды:
Протекают также побочные процессы окисления ионов металла до высшей валентности, окисление ПАВ и других органических веществ. В случае нерастворимых анодов ванна требует постоянной периодической корректировки.
рН
Можно выделить две проблемы:
1) Снижение рН (увеличение кислотности) приводит к росту выхода по току водорода. При этом выход по току металла падает. Выделяющийся водород может приводить к водородному питтингу. Пузырек Н2 находится на поверхности катода и экранирует ее часть – в этом месте получается дырка или питтинг при никелировании. В некоторых случаях, например разбавленный кислый электролит меднения, выделение водорода способствует перемешиванию электролита и улучшает его гальванические характеристики. Выделившийся водород может внедряться в стальную основу, вызывая охрупчивание стали. Это особенно характерно при цинковании стальных высокопрочных изделий. Поскольку ток обмена водорода на железе на несколько порядков выше, чем на цинке, то в начальный момент времени на поверхности стали преимущественно выделяется водород. В процессе хранения детали или эксплуатации водород может диффундировать из глубины стали к поверхности и вызывать вздутие покрытия.
2) Выделение Н2 приводит к увеличению рН прикатодного слоя, при этом комплексы металла меняют свой лигандный состав, образуется малорастворимое соединение. Они могут включаться в состав осадка, чем серьезно ухудшают его качество. Пример – допустим, что в электролите никелирования (кислом) находятся ионы [Ni(H2O)6 ]²+ в виде аквакомплекса:
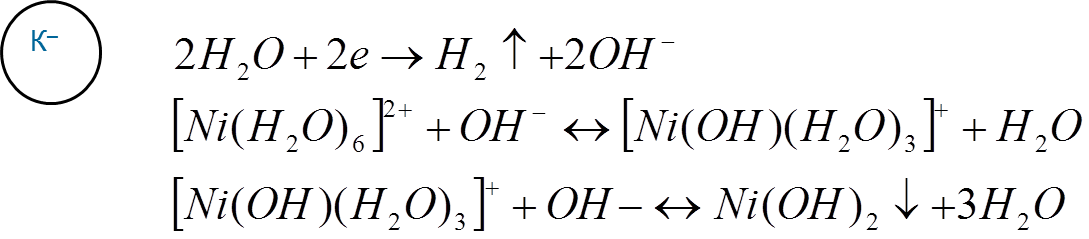
С целью поддержания постоянного значения рН вводятся буферизующие добавки. Это могут быть сильные/слабые кислоты, соли сильных кислот и слабых оснований.
Билет №4
