
- •Билет 1
- •1. Проблема получения низших углеводородов из высших в промышленности решается двумя методами.
- •Билет 3
- •Билет 4
- •1. Алюмосиликаты, как катализаторы в процессах каталитического крекинга. Природа активных центров. Соотношение алюминий: кремний и каталитическая активность алюмосиликатов.
- •2. Алкилирование бензола этиленом в присуствии хлористого алюминия сопровождается индукционным периодом. В чем причина этого явления.
- •Билет 5
- •Билет 7
- •Термодинамика реакции алкилирования изобутана изобутиленом.
- •Билет 8
- •Билет 9
- •1. Катализаторы в реакциях алкилирования изобутилена изобутаном.
- •Билет 10
- •Принципы "зеленой химии", используемые в алкилировании изобутана изобутеленом.
- •Билет 11
- •2. Каталитический крекинг пентана.
- •Билет 12
- •Билет 13
- •1. Все реакции алкилирования ароматических углеводородов непредельными соединениями протекают сходным образом. Эти превращения протекают в присутствии сильных кислот Бренстеда.
- •Билет 14
- •Билет 15
- •1.Термодинамика процессов ароматизации предельных углеводородов
- •Билет 17
- •1. Спилловер водорода. Экспериментальные данные по доказательству этого явления.
- •2. При алкилировании бензола этиленом в качестве побочного продукта образуется толуол, а при алкилирование бензола пропиленом — этилбензол и толуол. Какие реакции приводят к получению этих соединений?
- •Билет 18
- •1. В промышленной органической химии в качестве катализаторов при каталитическом крекинге используются твердые кислоты, которые в минимальной степени способны взаимодействовать со стенками аппаратуры.
- •2. Чтобы реакция прошла, необходимо провести протонирование непредельного соединения.
- •Билет 20
- •Билет 21
- •Характер кинетических кривых в процессе ароматизации гексана.
- •При платформинге н-гептана (470 - 510°с, 4 мПа) при изменении мольного соотношения водород: н-гептан от 2,5 до 24 степень превращения н-гептана возрастает от 15 до 80%. Чем это вызвано?
- •Билет 23
- •Катализаторы, используемые для алкилирования бензола этиленом.
- •Билет 24
Билет 1
1. Для получения всех низших углеводородов в настоящее время используют - нефть. Нефть представляет собой смесь высших углеводородов и продуктов их циклизации – смол и асфальтенов. Превращения высших углеводородов, содержащихся в нефтях, в низшие углеводороды задача промышленности. Без осуществления этого процесса вообще невозможно развивать промышленный органический синтез.
Проблема получения низших углеводородов из высших в промышленности решается двумя методами.
Первый подход основан на процессе пиролиза (термическом крекинге) углеводородов. Процесс пиролиза основан на том, что при высоких температурах высшие углеводороды расщепляются на гамму продуктов, среди которых преобладают низшие углеводороды. Пиролиз углеводородов сопровождается интенсивным образованием кокса.
Второй подход основан на каталитическом разложении высших углеводородов на низшие. Он получил название каталитического крекинга. Катализаторами в этом процессе являются синтетические алюмосиликаты, которые имеют кислый характер. В процессе каталитического крекинга удается до 95% процентов углеводородов превратить в полезные продукты. Поэтому химические производства, которые в своей основе используют в качестве сырья продукты каталитического крекинга, всегда будут иметь преимущество перед производствами, где сырье получают с установок пиролиза.
В настоящее время в мире производится 50 миллионов тонн пропилена в год. Доля получаемого пиролизом пропилена составляет 61%, на установках каталитического крекинга производят 34 % пропилена и 5 % другими методами.
Каталитический крекинг является кислотно-катализируемой реакцией. Протоны, получаемы в результате их отрыва от кислот, могут атаковать как любую углерод- углеродную связь, так и любую углерод-водородную связь молекул предельных углеводородов. При этом на первой стадии образуются карбониевые ионы, которые отщепляя либо молекулу предельного углеводорода, либо молекулу водорода дают первичные карбениевые ионы:

β-Распад карбениевых ионов – путь образования низших углеводородов из высших углеводородов
Образовавшиеся первичные карбениевые ионы являются неустойчивыми. Они распадаются с разрывом связи углерод-углерод, находящейся в β-положении относительно положительно заряженного центра:

Этот процесс повторятся вновь и вновь, пока в ходе реакции не образуется метильный карбениевый ион, либо протон:

Протон инициирует новые цепи разложения молекул предельных углеводородов, как это уже показано выше. Метильный катион является кислотой Льюиса, и также способен инициировать новые цепи разложения:
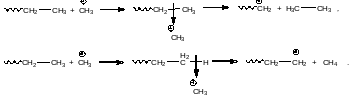
Реакция β-распада с разрывом углерод-углеродной связи является важнейшей целевой реакцией каталического крекинга. Именно этот процесс приводит к получению низших углеводородов из высших.
Хотя этилен в этом процессе и образуется, однако он является далеко не преобладающим продуктом. Более того, углеводороды, получаемые в результате расщепления линейных алканов в процессе каталитического крекинга, в основном, имеют разветвленную углеводородную цепь. Последнее обстоятельство повышает практическую ценность каталитического крекинга.
Причина того , что этилен не является основным продуктом состоит в том, что карбениевые ионы претерпевают не только β-распад с разрывом углерод-углеродной связи, но они вступают в ряд побочных превращений. Эти побочные превращения увеличивают количество видов карбениевых ионов, способных подвергаться реакции β-распада.
2. Химически чистый хлористый алюминий не проявляет никакой активности в реакциях алкилирования. Каталитическая активность хлористого алюминия начинает проявляться тогда, когда к нему дополнительно в реакционную систему вводят соединения с подвижным атомом водорода, например, воду, спирты, хлористый водород. Промоторами могут быть галоидные алкилы.
Такие соединения, как вода, спирты энергично реагируют с хлористым алюминием с выделением хлористого водорода:
AlCl3 + ROH → Al(OR)Cl2 + HCl ,
AlCl3 + H2O → Al(OH)Cl2 + HCl .
При взаимодействии хлористого алюминия с хлористым водородом в системе генерируется новой соединение – алюминийхлористоводородная кислота:
HCl + AlCl3 → H+[AlCl4]− .
Таким образом, при алкилировании ароматических соединений непредельными соединениями при катализе реакции хлористым алюминием на первой стадии принимают меры для генерации алюминийхлористоводородная кислота.
Алюминийхлористоводородная кислота является кислотой Бренстеда-Лаури. Однако алюминийхлористоводородная кислота не растворима в углеводородах. При введении этой кислоты в реакционную систему в ходе процесса наблюдается индукционный период, после которого реакция начинает нормально протекать.
Наблюдая за состоянием реакционной смеси в реакциях алкилирования ароматических соединений непредельными соединениями при катализе хлористым алюминием, Густавсон Г.Г. обратил внимание на то, что в ходе реакции на поверхности хлористого алюминия первоначально медленно образуется темно-коричневая маслянистая жидкость, которая частично растворима в углеводородах. Индукционный период в реакции алкилирования прекращается тогда, когда на поверхности катализатора появляется эта темная жидкость. Исследование процессов, протекающих на поверхности алюминийхлористоводородной кислоты, показало, что первоначально на этой поверхности медленно идет полиалкилирование бензола.
Основность образующихся полиалкилбензолов столь высока, что далее они образуют устойчивые катионные σ-комплексы с алюминийхлористоводородной кислотой.:

В ходе взаимодействия образуются σ-комплексы всех возможных структур. На приведенной выше схеме показаны только часть из образующихся σ-комплексов. Эти σ-комплексы окрашены. Они существуют в виде тесной ионной пары и обладают частичной растворимостью в углеводородах. Истинными катализаторами в реакциях алкилирования бензола этиленом являются не хлористый алюминий, не алюминийхлористоводородная кислота, а катионные σ-комплексы полиалкилбензолов с алюминийхлористоводородной кислотой. Появление отмеченных σ-комплексов в углеводородной фазе связано с переходом от гетерогенного катализа к гомогенному катализу. Протонирование молекул этилена в этом случае в углеводородной фазе ведется катионными σ-комплексами. При их взаимодействии с молекулами непредельных соединений генерируются алкильные катионы, например:

Катионные σ-комплексы, образующиеся в системе: непредельное соединение - алюминийхлористоводородная кислота – бензол, в настоящее время называют катализаторами (комплексом) Густавсона.
Билет 2
