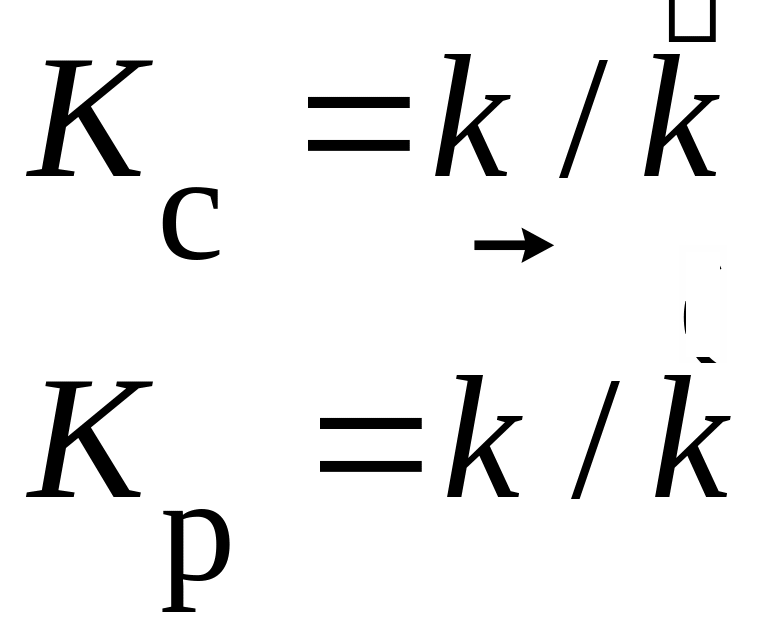- •Консультация по теме «Химическая кинетика»
- •Влияние концентрации на скорость реакции
- •Уравнения, связывающие концентрацию исходных веществ и время
- •Методы определения порядка реакции
- •Влияние температуры на скорость реакций
- •Неблагоприятная ориентация благоприятная ориентация
- •Следовательно
- •Влияние катализаторов на скорость реакции Катализ: ускорение реакции за счет введения дополнительного вещества – катализатора (Kt), состояние и масса которого в конце реакции остаются неизменными.
- •Особенности кинетики гетерогенных и обратимых реакций
- •Основные учебники и учебные пособия
Особенности кинетики гетерогенных и обратимых реакций
Гетерогенные реакции идут на поверхности раздела фаз, которая и служит реакционным пространством (поверхностью). Поэтому первой особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции. С учетом площади поверхности равной S общая скорость гетерогенной реакции первого порядка описывается уравнением:
|
|
|
где с – концентрация реагента (газообразного или жидкого).
Единица измерения скорости гетерогенной реакции в этом случае – мольс1, константы скорости реакции– мс1.
Твердое вещество в кинетическое уравнение не входит .
Например, кинетика гетерогенной реакции СаО(к) + СО2 = СаСО3(к)
описывается
уравнением:
![]()
Удельную
скорость реакции, отнесенную к единице
площади реакционной поверхности,
(для реакции первого порядка описывается
уравнением:
Единица измерения удельной скорости реакции мольс1м2. Скорость гетерогенной химической реакции зависит от скорости подвода реагента и отвода продукта с поверхности раздела фаз (зона химической реакции), что является второй особенностью этих реакций. Скорость обратимых гетерогенных и гоиогенных реакций зависит т скоростей прямой и обратной реакции: А + В = Д + К
Вывод: общая скорость необратимой гетерогенной химической реакции зависит, и удельная скорость реакции не зависит от площади реакционной поверхности. На скорость гетерогенной химической реакции влияют процессы массопереноса. Скорость обратимой реакции определяется разностью скоростей прямой и обратных реакций. |
|||||
|
|||||
|
|
|
|
|
|
Основные учебники и учебные пособия
1. Н.В.Коровин. Общая химия
2. Н.В.Коровин и др. Лабораторные работы по химии
3. Задачи и упражнения по общей химии. Под ред. Н.В.Коровина
4. Общая химия. Теория и расчеты. Под ред. Н.В. Коровина