
- •Министерство образования Российской Федерации
- •«Тюменский государственный нефтегазовый университет» в.М. Обухов общая химия
- •Введение
- •Глава 1. Основные понятия. Классы неорганических соединений. Химические уравнения. Типы химических реакций
- •1.1. Правила определения степени окисления (окисленности) элемента
- •1.2. Оксиды
- •1.3. Гидроксиды
- •1.3.1. Основания
- •1.3.2. Кислоты
- •1.4. Соли
- •Латинские названия элементов
- •1.5. Химические уравнения. Типы химических реакций
- •Глава 2. Основные закономерности химических процессов
- •2.1. Термодинамика химических процессов
- •Единицей измерения внутренней энергии является джоуль /Дж/.
- •2.2. Кинетика химических процессов
- •2.3. Химическое равновесие
- •Глава 3. Строение вещества
- •3.1. Строение атома
- •3.2. Строение молекулы
- •3.3. Агрегатные состояния вещества
- •Глава 4. Растворы. Свойства растворов
- •4.1. Состав раствора
- •4.2. Жидкие растворы (водные растворы)
- •4.2.1. Тепловой эффект растворения (энтальпия растворения)
- •4.2.2. Свойства растворов
- •4.2.3. Неэлектролиты и электролиты
- •4.2.4. Сильные и слабые электролиты
- •4.2.5. Электролитическая диссоциация воды. Водородный показатель. Нейтральная, кислая и основная среды
- •Глава 5. Реакции в растворах
- •5.1. Ионные уравнения. Реакции ионного обмена
- •Ионное уравнение запишется
- •5.2. Гидролиз солей
- •5.3. Окислительно-восстановительные реакции
- •5.4. Окислительно-восстановительные свойства элементов
- •5.5. Наиболее важные окислители и восстановители
- •Глава 6. Электрохимические процессы
- •6.1. Химические источники электрической энергии
- •Гальванический элемент записывают в виде электрохимической схемы. Электрохимическая схема элемента Якоби – Даниэля:
- •Электрохимическая схема: Аккумулятор (свинцовый )
- •6.2. Электролиз
- •Например. При электролизе водного раствора сульфата меди
- •Глава 7. Металлы. Коррозия металлов
- •7.1. Физические свойства металлов
- •7.2. Химические свойства металлов
- •7.2.1. Взаимодействие металлов с водой
- •7.2.2. Взаимодействие металлов с водными растворами щелочей
- •7.2.3. Взаимодействие металлов с кислотами
- •7.3. Коррозия металлов
- •7.4. Защита металлов от коррозии
- •7.4.1. Защита поверхности металла покрытиями
- •7.4.2. Электрохимические методы защиты поверхности металла
- •7.4.3. Использование ингибиторов коррозии.
- •Глава 5. Реакции в растворах………………………………………………...48
- •Глава 6. Электрохимические процессы……………………………………...56
- •Глава 7. Металлы. Коррозия металлов………………………………………66
- •Издательство «Нефтегазовый университет»
- •625000,Г. Тюмень, ул. Володарского, 38
- •625039,Г. Тюмень, ул. Киевская, 52
6.1. Химические источники электрической энергии
Химические источники электрической энергии (ХИЭЭ) – устройства, преобразующие энергию химической реакции в электрическую энергию.
ХИЭЭ, в которых протекают необратимые окислительно-восстановительные реакции (используются однократно), называются гальваническими элементами. ХИЭЭ, в которых протекают обратимые окислительно-восстановительные реакции (допускают многократное использование), называются аккумуляторами.
Гальванический элемент. Самый первый гальванический элемент Якоби-Даниэля состоит из цинкового электрода (цинковой пластинки, опущенной в раствор сульфата цинка) и медного электрода (медной пластинки, опущенной в раствор сульфата меди). Обе пластинки соединены проводником, а сосуды с раствором – электролитическим мостиком (трубка с раствором соли).
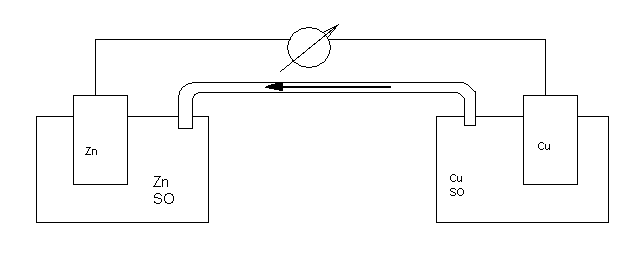
Рис. 3. Схема гальванического элемента Якоби-Даниэля
По отклонению стрелки гальванометра можно судить, что по внешней цепи идет электрический ток.
При изготовлении цинкового электрода на поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие: Zn <=> Zn2+ + 2e-. На медном электроде также устанавливается равновесие: Cu <=> Cu2+ + 2е-. Так как цинковый электрод имеет более низкое значение электродного потенциала (-0,76 В), чем медный электрод (+0,34 В), то на цинковом электроде легче идет окисление, поэтому больше накапливается свободных электронов. При замыкании внешней цепи электроны будут переходить от цинкового электрода к медному электроду и равновесное состояние процессов окисления и восстановления на электродах нарушится.
В результате на цинковом электроде равновесие сместится вправо –
т. е. в раствор перейдет дополнительное количество ионов цинка. Будет наблюдаться растворение цинковой пластинки. На цинковом электроде протекает процесс окисления:
Zn – 2e- = Zn2+.
В то же время медный электрод принимает электроны из внешней цепи и на нем также смещается равновесие, только в обратную сторону (влево). Ионы из раствора выделяются в виде атомов на медной пластине. На медном электроде идет процесс восстановления:
Cu2+ + 2е- = Cu .
В электрохимии электрод, на котором идет процесс окисления (отдача электронов), называется анодом. В гальваническом элементе анод имеет заряд (-). Электрод, на котором протекает процесс восстановления (принятие электронов), называется катодом. Катод в гальваническом элементе имеет заряд (+).
Первоначально в растворе электролита наблюдалось равенство катионов металлов и сульфат-ионов. Однако в процессе работы гальванического элемента на цинковом электроде катионы цинка, переходя в раствор с цинковой пластины, заряжают раствор положительно. На медном электроде катионы меди, переходя из раствора на медную пластину, заряжают раствор отрицательно за счет появления избытка сульфат-ионов. Поэтому в элементе наблюдается направленное движение ионов (SO42-) от медного электрода к цинковому электроду.
Итак, при работе гальванического элемента имеет место: движение электронов по внешней цепи – электронная проводимость; движение ионов в растворе – ионная проводимость.
Суммарное уравнение окислительно-восстановительной реакции (ОВР), протекающей в гальваническом элементе, запишется:
Ионное уравнение Zn + Cu2+ = Zn2+ + Cu.
Молекулярное уравнение Zn + CuSO4 = ZnSO4 + Cu.
