
- •Хімічний склад фпм
- •Властивості фпм
- •Процес виготовлення друкарських форм високого друку
- •Основне експонування
- •Вимивання
- •Додаткове ополіскування
- •Додаткове експонування
- •Процеси при опроміненні фпм
- •Області застосування фпм
- •Список літератури
- •1. Характеристика тфпк і рфпк
- •2. Технологічні процеси виготовлення фпм
- •3. Виробництво тфпк
- •Екструзійний спосіб
- •Метод пресування
- •4. Виробництво рфпк
- •5. Фотополімеризаційноздатні композиції для виготовлення друкованих форм
- •Світочутливість фпм
- •Проходження фотонів
- •Склад композиції
- •Типовий склад фотополімерних композицій для виготовлення флексографських фотополімерних друкованих форм.
- •Шлях фотона в композиції
- •Література
- •Від чого залежить розчинність?
- •Які бувають розчини?
- •Як і чим виявляти рельєфне зображення
- •Який розчинник використовувати найкраще
- •Процес сушіння
- •Сіра теорія “сирого процесу”
- •Методика експерименту
- •Результати експерименту
- •Сушильний пристрій у поливній машині
- •Література
- •Що таке липкість
- •Липкість поверхні флексографських фпф
- •Усунення липкості в поверхні ффпф
- •Обробка поверхні ффпф розчинниками реагентів
- •Додаткове експонування готових друкованих форм
- •Процес випару
- •Процес перегонки
- •Контроль розчинників
- •Альтернативні процеси
Процес випару
Рідина і пара являють собою гетерогенну систему двох агрегатних станів речовини т.зв. фаз, що мають поверхню розділу. Випар рідини, тобто перехід з рідкого агрегатного стану в газоподібне, називається фазовим переходом першого роду. Характерною ознакою такого переходу є стрибкоподібна зміна деяких фундаментальних параметрів речовини в момент переходу, наприклад, ентропії й обсягу. Речовина в газоподібному стані займає значно більший обсяг, тому що менше щільність і вона значно менш упорядкована, тому що набагато більше її ентропія, що є мірою безладдя в системі, ніж у рідкому стані. Відповідно до правила Трутона, при нормальній температурі кипіння більшості органічних розчинників ентропія зростає в середньому на 89 Дж/(до). Наприклад, у випадку кипіння 1.1,2,2-тетрахлоретана ентропія зростає на 92: н-бутанола – на 112: гексана – на 84,5, а води – на 109 Джмоль ДО).
Процес випару рідини або твердої речовини обумовлений Шиловим рухом молекул, тобто відбувається при температурі, що створює рух молекул. Однак при підвищенні температури збільшується інтенсивність тіньового руху молекул, тому зростає і швидкість випару.
Для переходу молекул рідини в парову фазу необхідно перебороти сили міжмолекулярного зчеплення і зовнішнього тиску, що вже утворили молекули пари. На виконання цієї роботи витрачається енергія теплового руху, у результаті чого рідина, що випаровується, прохолоджується. Чому знижується температура рідини, що випаровується? Тому , що при випарі рідини, у газову фазу переходять ті молекули, середня кінетична енергія яких нижче середнього рівня. Це і викликає зниження температури рідини. Для підвищення кінетичної енергії системи до середнього рівня необхідно додати порцію енергії ззовні. Та теплота, що поглинає рідина, рівноважна з парою при ізометричному випарі називається теплотою випару. Випар – це безперервний процес фазового переходу з рідкого в газоподібний стан, при якому збільшується концентрація молекул у газовій фазі, що викликає збільшення тиску пари. Для ідеальних розчинів, відповідно до закону Рауля, тиск пари розчинника (Р1) змінюється пропорційно його молярній частці (х1). Можна записати:
Рі=Р1,0*Хі,
де Рі – тиск пари над чистим розчинником, тобто коли Хі=1. Якщо ідеальний розчин складається з двох летючих компонентів (1 і “), то, відповідно до закону Дальтона, загальний тиск пари над розчином (Р) дорівнює сумі парціальних тиску (Рі і Р…) його компонентів, тобто:
Р=Р1+Р2=Р1,0*х1+Р2,0*х2.
У дійсності до ідеальних розчинів наближаються лише суміші близьких по хімічних властивостях речовин, у яких міжмолекулярна взаємодія між усіма компонентами суміші однакова, наприклад, розчини бензолу і толуолу, ізооктану й октану. Тому для реальних розчинів замість парціальних тиску компонентів Р, використовують так називані фугитивності f(летючості), що враховують відхилення реальних розчинів від законів Рауля-Дальтона.
Процес перегонки
Підвищення температури розчину приводить до збільшення тиску пари у газовій фазі. Температура розчину буде збільшуватися доти, поки тиск насиченої пари над ним не зрівнюється з зовнішнім тиском. Температура розчину, при якій спостерігається рівноважний випар з рідкого стану – називається температурою кипіння. Характерною ознакою процесу кипіння є пароутворення, що відбувається не тільки на поверхні, але й в обсязі рідини (утворення пухівців пари в обсязі рідини при її кипінні). При постійному тиску рідина кипить при постійній температурі. Температури кипіння органічних речовин залежать від їх молекулярної маси і хімічної будови. Вони є індивідуальними константами речовини. Температура кипіння розчину залежить від його сполуки. Вона підвищується зі збільшенням концентрації розчиненої низколетючої речовини. Пара над киплячим розчином по своїй сполуці відрізняється від сполуки рідини, тобто сполука рідкої і парової фаз неоднакова. Залежність сполуки рівноважної пари від сполуки розчину і загального тиску характеризується законом Коновалова. По першому з них підвищення відносного зміну компонента в рідкій фазі викликає збільшення його відносного вмісту у парах. При нагріванні суміші пара збагачується низькокиплячим, а рідина високо киплячим компонентом. Ця закономірність може бути проілюстрована діаграмою фазової рівноваги бінарної суміші компонента. А– низькокиплячий і В – висококиплячий, ща надана на рис. 1.
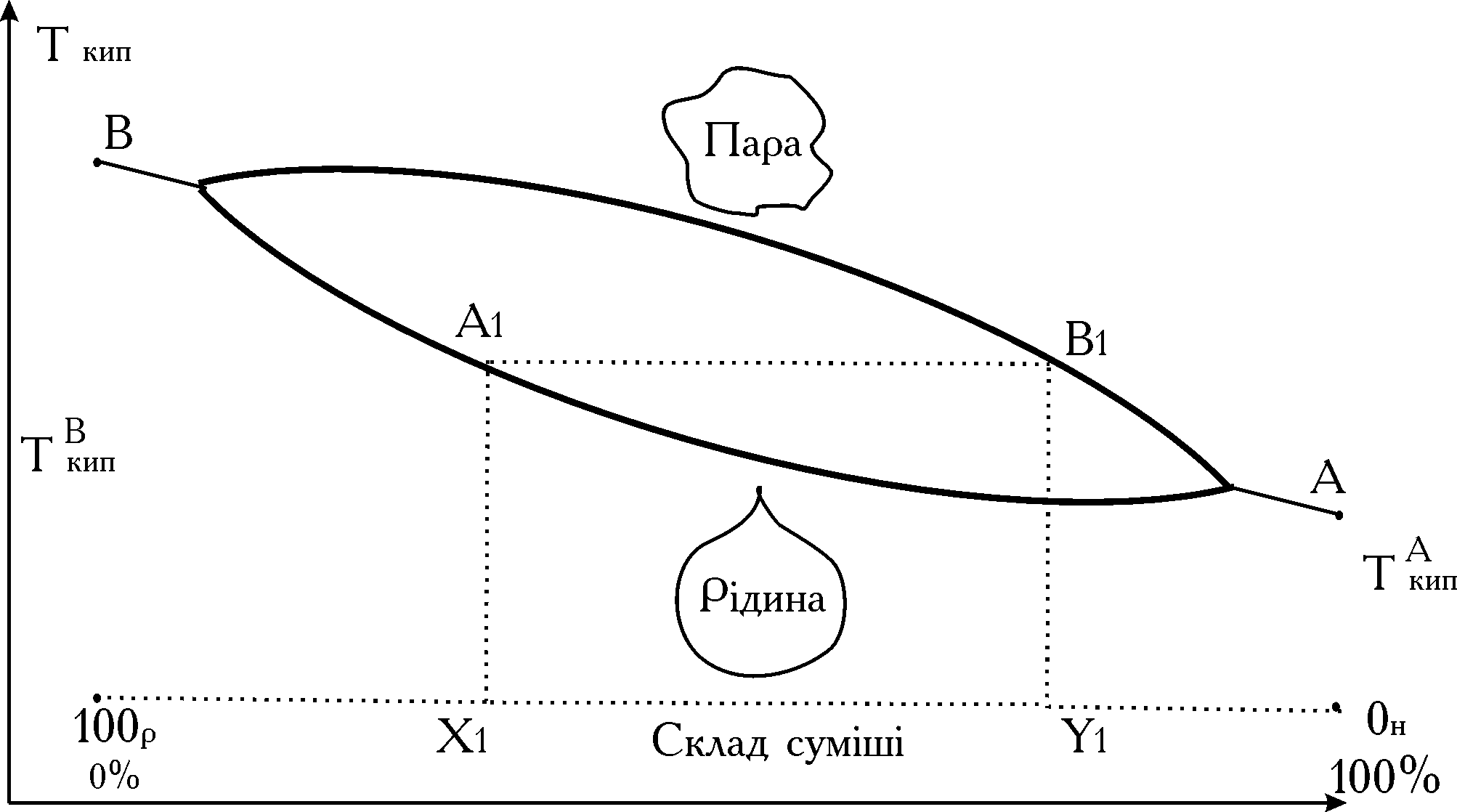
Рис. 1. Криві рівновісного складу рідин:
крива А-А1-В і парової (крива А-В1-В) фаз;
Х1 – склад рідинної фази суміші А-В;
Y1 – склад парової фази над киплячою сумішшю А-В. Зовнішній тиск постійний
Як видно з рис. 1, і температура кипіння ідеальної суміші нижче температури кипіння висококиплячого компонента (В) і вище температури кипіння низькокиплячого компонента (А). Опуклість (кривизна) кривої рівно ваги залежить від відношення теплоти випару компонентів суміші при одній і той же температурі. При перегонці усі компоненти суміші переходять у пароподібний стан у кількості пропорційній їх фугитивностям (летючості). Якщо поділювана суміш складається з двох компонентів, то при її перегонці пар збагачується легколетючим (низькокиплячим) компонентом. У процесі перегонки рідка фаза збіднюється, а парова збагачується низькокиплячим компонентом. В остаточному підсумку рідина, що випаровувалася, містить висококиплячий компонент, який називають залишком.
На відміну від ідеальних, реальні розчини часто утворюють суміші, що перегоняються без зміни сполуки і температури кипіння, тобто без поділу на компоненти. Такі суміші називаються азеотропічними або неподільно киплячими. Вид фазової діаграми такої суміші наданий на рис. 2. Більшість бінарних і потрійних азеотропічних сумішей має мінімальну температуру кипіння, що нижче, ніж температури кипіння компонентів суміші. Поділ азеотропних сумішей можливо шляхом зміни тиску при перегонці або за допомогою спеціальних видів перегонки з додаванням у систему додаткових компонентів. Перегонка суміші рідин може бути здійснена у вигляді одноразового (дистиляція) або багаторазового (ректифікація) повторення операції часткового випару рідини і конденсації її пари. Дистиляція (або проста перегонка) використовується для поділу сумішей, що мають велике розходження летучостей компонентів (або температур кипіння). При ректифікації масообмін між парою і рідиною, що конденсується (флегмою) повторюється багаторазово на експонентних пристроях (ректифікаційних колонах), що дозволяє ефективно розділяти навіть близькі за температурою кипіння рідини.
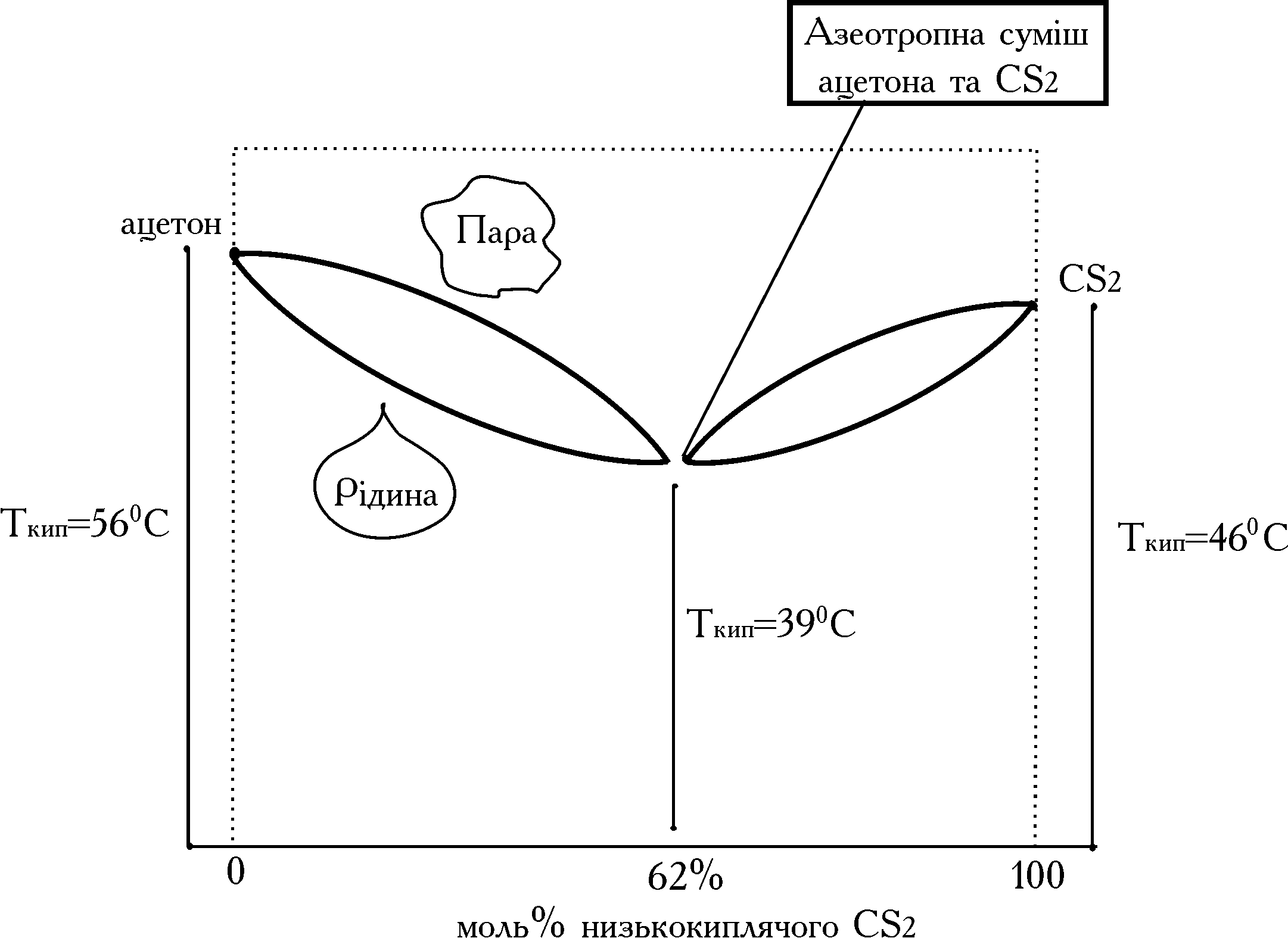
Рис. 2. Криві рівновісного складу рідинної і парової фаз для суміші ацетону і сірковуглецю.
Температура кипіння азеотропної суміші 390С.
Зовнішній тиск 760 мм. рт. ст.
Загальні енерговитрати на нагрівання і випар суміші рідин тим більше, чим вище температура кипіння, теплоємність і теплота випару кожного компонента суміші. Зустрічаються випадки, коли температура кипіння речовини вище температури його деструкції або початку хімічних перетворень, наприклад, полімеризації. Для зниження енерговитрат, що йдуть на нагрівання і запобігання небажаних термічних перетворень компонентів поділюваної суміші в процесі перегонки, використовують вакуумування.
Відомо, що температура кипіння речовин падає пропорційно зменшенню величини логарифма зовнішнього тиску. Тому однакові зміни величини тиску викликають різні зміни температур кипіння речовин у залежності від “глибини” вакууму. Так зміна тиску на мм. рт. ст. при атмосферному тиску зменшує температуру кипіння більшості органічних речовин лише на 0,03–0,064 але при залишковому тиску 4–5 мм. рт. ст. зменшення температури кипіння досягає вже 4–100С на 1 мм. рт. Ст. На практиці для орієнтованої оцінки температури кипіння у вакуумі використовують спеціальні емпіричні графіки – номограми. При вимиванні рельєфного зображення в розчинник переходить незаполімеризована фотополімеризована композиція (ФПК), що містить полімер і ряд висококиплячих компонентів: мономерів, пластифікаторів, фотоініціаторів і інших речовин. Концентрація ФПК у розчині досягає 10%, а загальна кількість вимивного розчину, наприклад, 100 кг. Тетрахлоретилен і н-бутанол утворять азеотропну суміш з мінімальною температурою кипіння, що дорівнює 1100С. За літературними даними відносний вміст тетрахлоретилена і н-бутанола при температурі кипіння азетропа дорівнює 68% і 32%. Тобто, така суміш збагачена н-бутанолом, у порівнянні з вихідним, чистим вимивним розчином.
Процес перегонки вимивного розчину може мати безперервний або періодичний характер. При організації процесу перегонки за безперервною схемою вимивний розчин надходить по трубопроводу з вимивного модуля регенераційну установку, а регенераційний розчинник повертається назад. У випадку здійснення перегонки за періодичною схемою, відпрацьований вимивний розчин накопичують в ємностях і періодично завантажують у регенераційну установку, вакуумують суміш і нагрівають її до температури кипіння при відповідному вакуумі. Після перегонки розчинник збирають і повертають у модуль для вибування. Перегонку суміші тетрахлоретилена і н-бутанола можна виконувати безупинно або періодично. Альтернативний розчинник OPTISOL 737 переганяють під вакуумом за безперервною схемою, а UNISOL i FLEXOSOL – по періодичній.
При атмосферному тиску регенерують розчини, що мають відносно високу температуру кипіння. Наприклад, вимивний розчин, що містить суміш тетрахлоретилена і бутанола. Вакуумування знижує загальні витрати енергії на перегонку і збільшує її швидкість. Це зниження обумовлене, в основному, зменшенням теплоти підігріву і випару суміші, що переганяється, внаслідок зменшення температури кипіння при вакуумуванні.
Кількість регенерованого розчинника (вихід) звичайно коливається в межах 70–90% в залежності від концентрації вимивного розчину, природи розчинників, конструкції регенераційної установки, кваліфікації оператора. Спроби –збільшити повноту регенерації невиправдано подовжують технологічний цикл і ускладнюють видалення високов’язкого кубового залишку, що являє собою суміш залишкових розчинників, полімерів, висококиплячих мономерів і нелетучих компонентів. Поки що єдиним способом утилізації залишку є його спалювання.
Нами розроблена сполука антикорозійних покрить на основі кубових залишків ФПК Флексофот і Cyrel.
