
- •Введение в энзимологию. Классификация и номенклатура ферментов.
- •История изучения ферментов
- •Оксидоредуктазы
- •Гидролитические ферменты
- •Триглицерид→1,2-диглицерид→2-моноглицерид→глицерин
- •48 000 До 143 000 Да) и по разному относятся к температуре и рН, действию ингибиторов и активаторов.
- •Глава 8. Ферменты
- •319 Глава 8. Ферменты
- •321 Глава 8. Ферменты
48 000 До 143 000 Да) и по разному относятся к температуре и рН, действию ингибиторов и активаторов.
Инулаза (Н.Ф. 3.2.1.7). Фермент осуществляет гидродиз инулина и других полифруктозанов по |3-1,2-фруктозидной связи, начиная с р-фрук-тозидного конца полимера. В результате образуется фруктоза и единственная молекула глюкозы на одну молекулу инулина. При полном гидролизе инулина получается 95% фруктозы и 5% глюкозы.
Фермент гидролизует главным образом инулин; сахароза, рафиноза также гидролизуются, но с незначительной скоростью. Инулаза содержится в тех же растениях (топинамбур, цикорий), в которых присутствует инулин. Активная инулаза продуцируется А5рег§Ши5 а^атоп ВКМ-808 при глубинном культивировании. Препарат обладает высокой стабильностью к Н+-ионам и температуре. Оптимум рН действия 4,5; оптимум температуры — 65°С.
Полученные из инулина фруктозные сиропы могут быть широко использованы в кондитерской промышленности и диетическом питании. $-Фруктофуранозидаза (Н.Ф.3.2.1.26). Другие названия этого фермента — инвертаза или сахараза.
Для промышленного производства имеют значения только ферменты из 5. сегеуЫае и 8. саг18Ьег§еп51з. р-Фруктофуранозидазу выделяют из дрожжей путем автолиза. Этот фермент гидролизует сахарозу па р~фрук~

В результате действия фермента на сахарозу получается смесь экви-молярных количеств сс-глюкозы и р-фруктозы, получившая название «ин-вертного сахара». Термин «инверсия» обозначает изменения, происходящие в способности сахара вращать плоскость поляризованного света. Это можно выразить следующей схемой:
Сахароза + Н2О ——» О (+)-глюкоза + О (—)-фруктоза
[а] „= +66,5° [а] 0 = +52,5° [а] в = -92,4е
Оптимум рН дрожжевой инвертазы находится в достаточно широкой зоне от 4,0 до 5,5. Фермент ингибируется ионами металлов. Полное ингибирование происходит под действием ртути и свинца; частичное ингибирование вызывают ионы серебра, цинка, меди. |3-Фруктофура-нозидаза гидролизует также рафинозу и метил-|3-В-фруктофуранозид, причем, если относительную скорость гидролиза сахарозы принять за 100, то соответствующие скорости расщепления этих субстратов будут равны 47 и 77.
Инвертаза находит широкое применение в пищевой промышленности. Гидролиз концентрированных растворов сахарозы приводит к образованию более сладких сиропов. Точка кипения инвертированных сиропов выше, а точка замерзания ниже, т. к. при инверсии повышается осмотическое давление. Образовавшиеся при действии инвертазы моносахариды более растворимы, не так легко выкристаллизовываются из высококонцентрированных сиропов. Практическое использование инвертазы в кондитерской промышленности будет рассмотрено в разделе 8.3.
(3~Галактозидаза (Н.Ф.3.2.1.23). Фермент, который часто называют лактазой, катализирует реакцию гидролитического отщепления нередуцирующих остатков |3-В-галактозы в |3-галактозидах, в частности, в молочном сахаре — дисахариде лактозы:

Ферментные препараты лактазы, применяемые в пищевой промышленности, получают с помощью различных продуцентов: микроскопических грибов (А. огугае, А, ш§ег), бактерий (Е. со1], ЬасЮЪаеШиз), дрожжей (5. гга&Шз, 3. рзейогторгсаНз), Все они имеют различные температурные оптимумы, которые, однако, лежат в пределах 37—50"С. Оптимумы рН этих ферментов также заметно отличаются: для бактериальных — около 7,0; для грибных — около 5,0; для дрожжевой лактазы — около 6,0.
При гидролизе лактозы в цельном молоке, обезжиренном молоке или в концентратах молока оптимальную активность (при нейтральном рН этих субстратов) проявляет дрожжевой фермент; для сыворотки и ее концентратов — грибной. Причем в обезжиренном молоке или сыворотке лактоза гидролизуется легче, чем в цельном, а пастеризованные субстраты гидролизуются легче, чем непастеризованные.
(З-Галактозидаза из Е.соН была получена в кристаллическом состоянии, ее молекулярная масса 850 000 Да. Она ингибируется некоторыми металлами (Си, 2п). Восстанавливающие агенты (цистеин, сульфид N3, сульфит На и др.) активируют фермент и способны преодолевать влияние ингибиторов-металл ов.
У некоторых групп населения (исключение составляют жители Северной Европы и некоторых районов Африки) ярко выражена непереносимость (интолерантность) лактозы, связанная с полным или частичным исчезновением у взрослых людей лактазной активности в клетках кишечного эпителия. У грудных младенцев активность этого фермента очень высока.
Эндополигалактуроназа (Н.Ф.3.2.1.15) и экзополигалактуроназа (Н.Ф.3.2.1.67). Эти два фермента участвуют в превращениях пектиновых лсщсств наряду с другими пектолитическими ферментами растительного и микробного происхождения (см. также гл. 3).
Эндополигалактуроназа — фермент, который гидролизует а-1,4-свя-зи в молекуле растворимого пектина (метоксилированной полигалакту-роновой кислоты), неупорядоченным, произвольным образом. С возрастанием степени этерификации полигалактуроновой кислоты степень и скорость гидролиза падают, т. к. для проявления каталитической актив-] юсти фермента требуются свободные карбоксильные группы. Большинство изученных эндополигалактуроназ микроскопических грибов имеют молекулярную массу от 30 000 до 40 000 Да. Оптимальные значения рН колеблются в диапозоне 3,8—5,5.
В гидролизе этого типа связи принимает участие и другой фермент — экзополигалактуроназа, который последовательно отщепляет молекулу галактуроновой кислоты, начиная с нередуцирующего конца. Эндополигалактуроназа синтезируется как грибами, так и некоторыми видами бактерий. Они отличаются по своей специфичности к пектинам из различных источников, конечными продуктами реакции, оптимуму рН и другим свойствам.
Для промышленного производства ферментных препаратов пек-толитических ферментов, которые являются комплексными, в качестве продуцентов используют в основном микроскопические (плесневые) грибы, в частности, грибы рода АврегёШш: А. пщег, А. \уепШ, Л. огугае. Бактериальные ферменты в промышленных масштабах не производятся.
Растительные полигалактуроназы, по-видимому, похожи на грибные полигалактуроназы. Они обнаружены в широком спектре плодов и овощей: помидорах, авокадо, редисе, огурцах, яблоках, грушах, цитрусовых и др. Все они проявляют активность при естественных рН плодов.
промышленности достаточно обширно. Они используются при производстве фруктовых соковых концентратов и экстрактов, при осветлении соков и вин, при производстве фруктовых и овощных пюре и нектаров.
Целлюлолитические ферменты. Ферментативное разрушение целлюлозы и родственных ей полисахаридов (гемицеллюлозы, лигнина) — сложный процесс, требующий участия комплекса ферментов. Продуцентами такого комплекса целлюлолитических ферментов являются грибы рода Тпспойеппа, РЬапсгосЪаеге (5рого1пспит) и Ризагшт, а также бактерии рода С1о51пс1шт, СеНЫотопаз и некоторые другие.
Три основных типа целлюлолитических ферментов, продуцируемых микроскопическими грибами, образуют комплекс ферментов, способных осуществить полный гидролиз целлюлозы:
Эндо-1,4-/3-глюконаза или целлюлаза (Н.Ф.3.2.1.4) беспорядочно гид- ролизует р-1,4-гликозидныс связи. Она не расщепляет целлобиозу, но гидролизует целлодекстрины и производные целлюлозы с высокой сте пенью замещения, т. к. специфичность этого фермента не высока.
Экзо-1,4-$-глюконаза или целлобиогидролаза (Н.Ф.3.2.1.91) действует на целлюлозу, отщепляя целлобиозные звенья с нередуцирующего кон ца цепи. Этот фермент не действует на замещенные производные цел люлозы , что указывает на более высокую субстратную специфичность, чем у эндоглюконазы, Целлобиогидролаза гидролизует целлодекстри ны, но не действует на целлобиозу.
р-Глюкозидаза(И.Ф.3.2.\.2\) расщепляет целлобиозу и целлоолигоса- хариды до глюкозы. Фермент не действует на целлюлозу и высшие оли- госахариды.
Целлюлазная система бактерий существенно проще, чем у грибов, т. к. бактерии образуют только эндоглкжоназу и |3-глюкозидазу.
Все ферменты целлюлолитического комплекса достаточно хорошо изучены: практически все они являются гл и ко протеидам и, определены их молекулярные массы, изоэлектрические точки, для многих показано наличие множественных форм.
Доказано, что различные ферменты, гидролизующие высокоупорядоченную целлюлозу, действуют в синергизме (рис. 8.10).
Эндоглюконаза атакует аморфные участки целлюлозных фибрилл. В результате образуются новые целлюлозные цепочки, на которые действует целлобиогидролаза, отщепляя целлобиозные звенья с нередуцирующего конца. Синергизм между двумя этими ферментами проявляется в том, что в результате действия эндоглюконазы появляется новый субстрат (более короткие цепочки), на который действует уже целлобиогидролаза. р-Глкжозидаза усиливает гидролиз, расщепляя целлобиозу — конечный продукт и ингибитор этих ферментов.
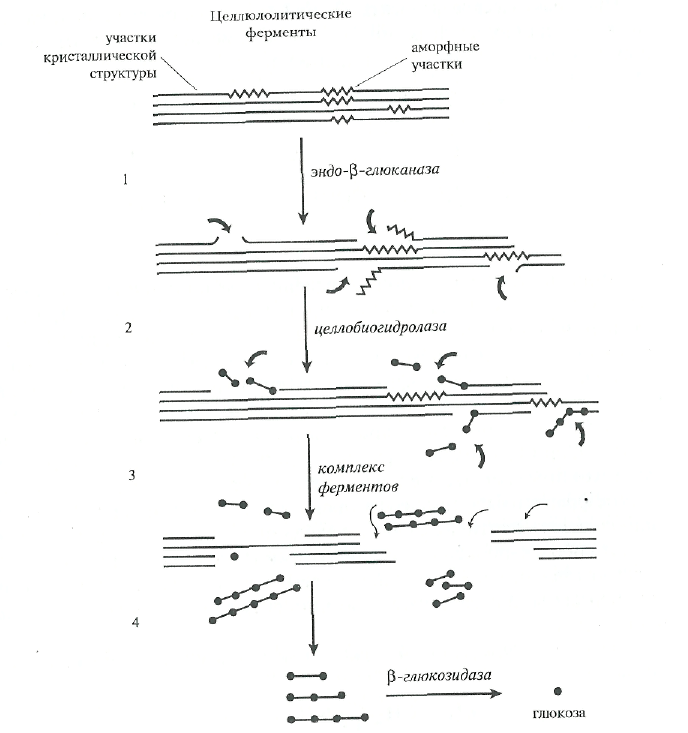
Рис. 8.10. Схема ферментативного гидролиза целлюлозы
Применение целлюлолитических ферментов представляет большой интерес, т. к. ферментативный гидролиз целлюлозосодержащих материалов (древесина, торф, сельскохозяйственные и городские отходы) может обеспечить получение различных биотехнологичсских продуктов (глюкозы, этанола, ацетона, микробной биомассы). В настоящее время исследования ферментативного расщепления целлюлозы достигли такого уровня, когда имеются все необходимые условия для разработки промышленного процесса и лишь по экономическим причинам он не реализуется на практике.
Протеолитнческие ферменты (Н.Ф.3.4). Основной реакцией, катализируемой протеолитическими ферментами, является гидролиз пептидной связи в молекулах белков и пептидов.
-МН-СН-СО-КН-СН-СО- + Н2О ->
I I
К, К2
-* -МН-СН-СООН + МН2-СН-СО-
я, *2
Согласно первоначальной классификации протеолитических ферментов их делили на две группы: протеиназы и пептидазы. При этом считали, что протеиназы действуют на белки, расщепляя их до полипептидов; полипептиды же гидролизуются пептидазами до аминокислот. Более поздняя классификация, до сих пор сохранившая свое значение, основана на схеме, предложенной М. Бергманом и Д. Фрутоном (1937). Согласно этой схеме протеазы разделяются на эндо- и экзопептидазы. Ферменты первой группы (эндопептидазьг) могут гидролизо-вать глубинные пептидные связи и расщеплять молекулу белка на более мелкие фрагменты; ферменты второй группы (экзопептидазы) не могут гидролизовать пептидные связи, находящиеся в середине цепи, и действуют либо с карбоксильного, либо с аминного конца цепи, отщепляя последовательно одну за другой концевые аминокислоты. В связи с этим экзопептидазы подразделяют на аминопептидазы, карбоксипептидазы и дипептидазы.
Аминопептидазы (Н.Ф.3.4.11) катализируют отщепление М-концевых аминокислот.

Карбоксипептидазы (Н. Ф. 3.4.12) катализируют отщепление С-кон-цевых аминокислот.
...-Г4Н-СН-С-Г-НН-СН--СООН

Дипептидазы (Н.Ф.3.4. 13) проявляют специфичность к дипептидным субстратам.
Вместе с тем эндопептидазы (протеиназы) разделены на подгруппы, начиная с подподкласса 3.4,21, в первую очередь на основании катали-
316
тического механизма (строения активного центра); особенности специфичности используются при этом только для идентификации индивидуальных ферментов в пределах подподкласса:
— сериновые протеиназы (Н.Ф.3.4.21), в активном центре которых функ ционирует остаток серина и гистидина;
тиоловые (цистеиновые) протеиназы (Н.Ф.3.4.22), содержат в актив ном центре 5Н-группу остатка цистеина;
кислые (карбоксильные) протеиназы (Н.Ф.3.4.23), в активном центре содержат СООН-группу остатка аспарагиновой кислоты;
— металлопротеиназы (Н.Ф.3.4.24), содержат в активном центре металл, необходимый для проявления их каталитической активности.
Группа протеиназ, о механизме действия которых ничего неизвестно, отнесена к подподклассу 3.4.99.
Субстратная специфичность протеиназ будет определяться следующими факторами: природой аминокислоты, образующей гидролизуемую пептидную связь; радикалами аминокислот, удаленными от гидролизуе-мой пептидной связи; общей пространственной конформацией молекулы белка, делающей определенные пептидные связи доступными для действия фермента.
Исследование протеолитических ферментов ведется весьма интенсивно. Это происходит вследствие того, что они являются чрезвычайно удобным объектом для изучения структуры белков, активных центров ферментов, механизмов регуляции ферментативной активности и других важных вопросов энзимологии; кроме того, протеазы широко применяются в различных отраслях промышленности: пищевой, сельском хозяйстве,
медицине.
Промышленное применение препаратов протеаз будет описано в разделе 8.3. Здесь же мы остановимся на рассмотрении отдельных свойств протеаз, имеющих технологическое значение, предварительно разделив их по типу происхождения на растительные, животные и микробные.
Растительные протеазы. Споры о приоритетности тех или иных ферментных препаратов, полученных из названных источников, ведутся уже достаточно долго. Однако, в связи с ограниченностью животного сырья (внутренние органы крупного рогатого скота и свиней), а также возможной токсичностью микробных препаратов (все они требуют высокой степени очистки, хотя и это не может служить абсолютной гарантией их безопасности), большой интерес представляют растительные протеазы, лишенные указанных недостатков.
Паггаин (Н.Ф.3.4.22.2) нхимопапаин (Н.Ф.3.4.22.6). Папаин является наиболее применяемым в производстве протеолитическим ферментом. Ферменты папайи и химопапаин — истинные ферменты латекса плодов дынного дерева (Сапса рарауа).
Дипептидазы (Н.Ф.3.4. 13) проявляют специфичность к дипептидным субстратам.
Вместе с тем эндопептидазы (протеиназы) разделены на подгруппы, начиная с подподкласса 3.4,21, в первую очередь на основании катали-
316
