
- •Введение в энзимологию. Классификация и номенклатура ферментов.
- •История изучения ферментов
- •Оксидоредуктазы
- •Гидролитические ферменты
- •Триглицерид→1,2-диглицерид→2-моноглицерид→глицерин
- •48 000 До 143 000 Да) и по разному относятся к температуре и рН, действию ингибиторов и активаторов.
- •Глава 8. Ферменты
- •319 Глава 8. Ферменты
- •321 Глава 8. Ферменты
Гидролитические ферменты
Роль ферментов класса гидролаз в пищевых технологиях очень велика. Это находит отражение в специальной литературе, монографиях, технических инструкциях, стандартах. Поэтому в этом разделе остановимся на краткой характеристике наиболее важных представителей гидролитических ферментов. Для технологов наибольший интерес представляют три подкласса ферментов класса гидролаз. Это ферменты, действующие на сложноэфирные связи — эстеразы (Н.Ф.3.1); действующие на гликозидные соединения — гликозидазы (Н.Ф.3.2) и действующие на пептидные связи — протеазы (Н.Ф.3.4).
Эстеразы (Н.Ф.3.1). Этот подкласс включает большое число ферментов (около 150), которые разделены на семь подподклассов: ферменты, действующие на эфиры карбоновых кислот (3,1.1); эстеразы тиоловых эфиров (3.1.2); гидролазы фосфорныхмоноэфиров или фосфатазы (3.1.3); гидролазы фосфорных диэфиров (3.1.4); гидролазы моноэфиров олиго-фосфорных кислот (3.1.5); сульфатазы (3.1.6); эстеразы моноэфиров дифосфорных кислот (3.1.7).
Наиболее важными с точки зрения участия в различных биохимических процессах, имеющих место при хранении и переработке пищевого сырья, являются ферменты подподкласса 3.1.1.
Липаза (Н.Ф.3.1.1.3). Липаза или триацилглицероллипаза широко распространена в природе и играет важную роль в процессах, протекающих при переработке и хранении пищевых продуктов. В настоящее время выделены и охарактеризованы липазы растительного происхождения (липаза клещевины, пшеницы и других злаков), животного (панкреатическая липаза, липаза молока) и микробного (бактериальные и грибные липазы).
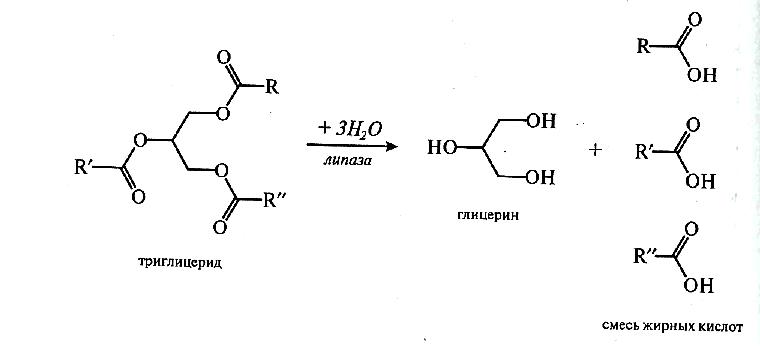
Причем предпочтительнее гидролизуются связи в положении 3 и 1 и лишь затем в положении 2. Многочисленные экспериментальные данные дают основание предположить следующий путь липолиза:
Триглицерид→1,2-диглицерид→2-моноглицерид→глицерин
Установлено, что липазы быстрее отщепляют остатки высокомолекулярных жирных кислот, чем низшие карбоновые кислоты. Ферментативный гидролиз липидов имеет существенное отличие от других гидролитических реакций. Парадокс заключается в том, что липаза — водорастворимый фермент, а ее субстрат гидрофобен; однако активность липазы возрастает на границе «вода — липид». Этот феномен известен под названием «межфазная активация».
Липазы различного происхождения сильно отличаются друг от друга но специфичности действия, сродству к различным субстратам, растворимости, оптимуму рН и другим свойствам. Так, например, липаза семян клещевины нерастворима в воде, имеет оптимум рН 4,7 — 5,0; панкреатическая липаза растворима, и оптимум рН ее действия лежит в слабощелочной среде. Липазы микробного происхождения и липаза пшеничных зародышей также отличаются от липазы клещевины. Они растворимы в воде и имеют рН оптимум при 8,0. Липаза молока, молекулярная масса которой примерно 7000 Да, имеет оптимум рН 9,0 — 9,2 при гидролизе молочного жира.
Зерновая липаза участвует в процессе порчи зерновых продуктов при хранении. Особенно это касается продуктов, содержащих повышенное количество жира, например, овсяной муки или крупы, пшена. Накопление свободных жирных кислот под действием липазы (рост кислотного числа жира) — признак ухудшения качества продукта. Свободные жирные кислоты, особенно ненасыщенные, легко подвергаются окислению под воздействием разных факторов: липоксигеназы, тепловой обработки, кислорода воздуха, солнечного света и др. Таким образом, липазы могут инициировать процесс прогоркания и ограничивать сроки хранения пищевых продуктов.
Одна из особенностей липаз связана с тем, что эти ферменты способны катализировать и обратную реакцию, осуществлять синтез сложных эфиров, а также производить переэтерефикацию триглицеридов, т. е. изменять их жирнокислотный состав. На этом основании разрабатываются способы получения новых форм жировых продуктов с использованием специфических липаз. Так, например, путем реакции переэтерификации делаются попытки получения жира — аналога масла какао из дешевого исходного сырья.
Пектинэстераза (Н.Ф.3.1.1.11). Пектинэстеразы синтезируются высшими растениями, микроскопическими грибами, дрожжами и бактериями. Пектинэстераза катализирует гидролиз сложноэфирных связей в молекуле растворимого пектина, в результате чего образуется метиловый спирт и полигалактуроновая кислота. Процесс протекает согласно следующей схеме (стрелками показано действие фермента):

Таким образом, пектинэстераза отщепляет метоксилъные группы от метоксилированной полигалактуроновой кислоты (см. также гл. Углеводы).
Желирующая способность пектина зависит от степени метоксилиро-вания или степени этсрификации, поэтому действие пектинэстеразы по отщеплению метоксильных групп приводит к снижению желирующей способности и сопровождается падением вязкости. На этом, очевидно, и основывается применение этого фермента для осветления плодовых соков и вина. Обычно комплексные препараты пектолмтических ферментов, применяемые для этих целей, получают из различных плесневых грибов, и прежде всего из А. п1§ег.
Лэдролазы гликозидов или гликозидазы (Н.Ф.3.2). Этот подкласс включает около ста ферментов с разной специфичностью действия, осуще-ствяющих гидролиз олиго- и полисахаридов; некоторые ферменты этого типа способны осуществлять трансферазные реакции — переносить гли-козидные остатки на олиго- и полисахариды, наращивать подисахарид-ные цепочки. Представители гликозидаз были одними из первых ферментов, обратимость действия которых ш \Иго была экспериментально доказана.
Основной формой запасных углеводов в семенах и клубнях растений является крахмал. Ферментативные превращения крахмала лежат в основе многих пищевых технологий. Поэтому ферменты а мил олити чес кого комплекса растительного, животного и микробного происхождения интенсивно изучаются со времени их открытия Кирхгофом в 1814г. и до настоящего времени.
сс~Амш1азаЩ,Ф.3.2ЛЛ). а-Амилазы обнаружены у животных (в слюне и поджелудочной железе), в растениях (проросшее зерно пшеницы, ржи, ячменя), они вырабатываются плесневыми грибами и бактериями. Все эти ферменты гидролизуют крахмал, гликоген и родственные а-1,4-глюканы с образованием, главным образом, декстринов и небольшого количества дисахарида — мальтозы.
а-Амилазы гидролизуют а-1,4-связи внутри молекулы крахмала, разрывая связь между первым углеродным атомом и кислородом, связывающим этот углерод с соседней молекулой глюкозы. Это наглядно демонстрирует следующая схема (стрелками показано действие фермента):
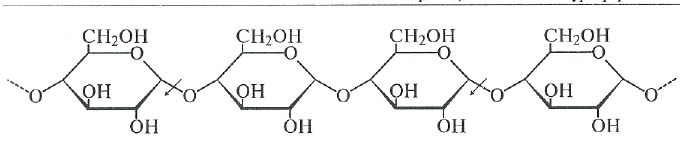
Скорость, с которой а-амилазы гидролизуютглюканы различной степени полимеризации, быстро уменьшается по мере ее снижения. Амилоза — линейная фракция крахмала, гидролизуется быстрее, чем амило-пектин, имеющий разветвленную структуру.
Скорость гидролиза а-амилазой зависит от вида и состояния крахмала (нативный или клейстер изо ванны и крахмал), а также от эффективности самих амилаз. На основании параллельно проводившихся опытов (в одних — действовали препаратами амилаз на клейстеризованный крахмал, а в других — эквивалентными концентрациями на нативные крахмальные зерна) было показано, что эффективность амилаз различного происхождения уменьшается в следующем порядке: панкреатическая, солодовая, бактериальная, грибная.
Характерной особенностью всех а-амилаз является наличие одного атома Са на молекулу фермента. Роль кальция состоит в том, что он стабилизирует вторичную и третичную структуру молекулы а-амилазы, обеспечивая таким образом ее каталитическую активность и вместе с тем предохраняя фермент от действия протеолитических ферментов и тепловой денатурации.
Различные а-амилазы отличаются по молекулярной массе, устойчивости к нагреванию и некоторым другим показателям. Молекулярная масса а-амилаз близка к 50 000 Да, за исключением бактериальной а-амилазы, которая имеет молекулярную массу 96 900 Да (кристаллический препарат). Так, например, широко применяемая в промышленности а-амилаза из плесневого гриба А. огугае, полученная в кристаллическом виде, имеет молекулярную массу 51 860 Да.
Большое практическое значение имеет влияние температуры и рН на стабильность амилаз. Быстрое разрушение зерновой а-амилазы при рН 3,3—4,0, например, дает возможность выпекать ржаной хлеб из муки, которая содержит избыток а-амилазы, при низких значениях рН, чтобы предотвратить излишнее декстринирование крахмала и образование клейких веществ в мякише хлеба.
Говоря о термостабильности а-амилаз различного происхождения, можно расположить их в следующем ряду по мере снижения устойчивости к нагреванию: бактериальные амилазы — зерновые амилазы — грибные амилазы.
Последними работами в области изучения амилаз показано, что в семенах растений присутствуют два типа а-амилазы: а-амилаза созревания и а-амилаза прорастания.
В созревающем зерне синтезируется а-амилаза созревания, которая затем переходит в латентную форму, локализуясь на мембранах алейронового слоя. Первый этап гидролиза крахмала при прорастании осуществляется этой а-амилазой. И только на следующем этапе в работу включается вновь синтезируемый фермент — сс-амилаза прорастания. Ее синтез в клетках зародыша и алейронового слоя начинается при влажности зерна выше 28%. Две формы а-амилазы семян злаков различаются по термостабильности: а-амилаза созревания при 70°С теряет 50% своей активности, тогда как а-амилаза прорастания при этой температуре только незначительно снижает свою активность.
Интенсивность гидролиза крахмала в перерабатываемом сырье, как уже отмечалось ранее, определяется взаимодействием многих факторов. Это прежде всего состояние амилаз созревшего зерна и возможность перехода части латентной формы в свободное состояние. Это и состояние субстрата, его доступность действию фермента (атакуемость субстрата). Большое значение имеет и фракционный состав крахмальных гранул, соотношение мелких и крупных зерен, а также содержание поврежденных зерен крахмала, которые легче поддаются действию ферментов.
Как было установлено в последнее время, важная роль в этом процессе принадлежит протсолитическим ферментам. Протеазы, осуществляя ограниченное расщепление белков, способствуют освобождению амилаз из связанного состояния, а также гидролизуютту часть запасных белков, которая прочно связана с поверхностью крахмальных гранул, облегчая тем самым доступ фермента к субстрату.
Мощным механизмом регуляции скорости расщепления крахмальных гранул является система белковых ингибиторов амилаз, широко представленных в растениях. Ингибиторы белковой природы избирательно взаимодействуют с амилазами и образуют неактивные комплексы «амилаза—ингибитор». Высокой активностью обладают ингибиторы амилаз картофельного сока. Из зерна пшеницы выделен ингибитор с двумя активными центрами (двухцентровой). Один активный центр имеет сродство к протеазам и способен блокировать их действие. Другой активный центр имеет сродство к амилазам. Таким образом, один ингибитор белковой природы способен блокировать работу как протеаз, так и амилаз. В образующемся надмолекулярном комплексе ингибитор выполняет своеобразную роль связывающего звена, подавляя активность ферментов разного механизма действия.
@-Амшаза(Н.Ф3.2.1.2). р*-Амилаза отщепляет мальтозу от нередуцирующего конца цепи, разрывая гликозидные связи через одну. Название «р-амилаза» было выбрано для того, чтобы показать, что мальтоза образуется в (З-аномерной форме. Это не означает, что в молекуле крахмала присутствуют [3-связи, а указывает скорее на то, что происходит инверсия конфигурации, которая может иметь место в процессе ферментатив-
пого превращения вещества, содержащего асимметрический атом углерода. Такая инверсия была открыта П. Вальденом в 1893 г. и поэтому названа вальденовской инверсией. На представленной ниже схеме действие (3-амилазы на амилозу и амилопектин показано стрелками.
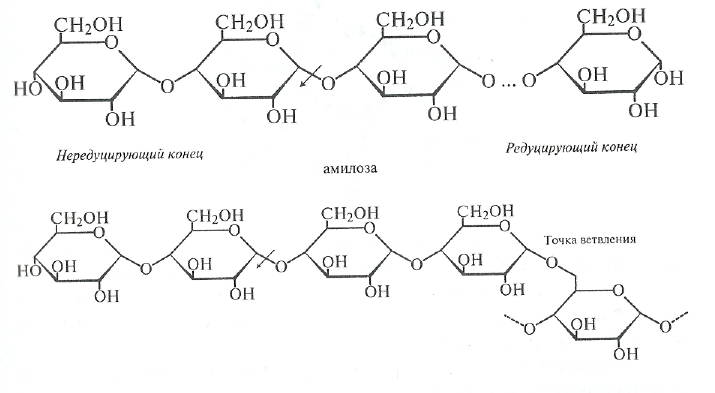
амилопектин
Таким образом, действуя упорядочение, |3-амилаза последовательно отщепляет остатки мальтозы с нередуцирующего конца до тех пор, пока не встретится точка ветвления со связью а-1,6. При этом амилоза под действием р-амилазы расщепляется до мальтозы на 100%, а при действии |-1-амилазы на амилопектин помимо образующейся мальтозы остается нетронутой крупная, сильно разветвленная сердцевина, так называемый «конечный декстрин», т. к. фермент прекращает свое действие за 2—3 остатка глюкозы отточек ветвления.
(З-Амилазы — это ферменты в основном растительного происхождения. Хорошо известными источниками являются зерно пшеницы, а также пшеничный и ячменный солод, соевые бобы, клубни картофеля.
В отличие от а-амилазы, |3-амилаза менее термостабильна, но проявляет большую устойчивость к кислым значениям рН, сохраняя свою активность при рН 3,3. Это нашло свое отражение в способе разделения о> и р-амилаз солода, где оба фермента присутствуют одновременно.
Глюкоамилоза (Н.Ф.3.2.1.3). Глюкоамилаза (у-амилаза) продуцируется различными видами плесневых грибов рода Азрсг§Шш: А. огугае, А. ш§ег, А. а\уатогу и некоторыми другими, например, КЫ2Ори$с1е1атагиКЫгори5 туеиз. Эти ферменты расщепляют как амилозу, так и амилопектин до глюкозы, последовательно действуя с нередуцирующего конца цепи крахмала. Они способны гидролизовать а-1,4 и а-1,6 гликозидные связи.
 Различные глюкоамилазы отличаются друг
от друга скоростью гидролиза крахмала,
отношением к температуре и рН, и некоторыми
другими показателями. На использовании
препаратов грибной глюкоамилазы
разработан ферментативный метод
получения глюкозы, который получил
широкое распространение в Японии.
Различные глюкоамилазы отличаются друг
от друга скоростью гидролиза крахмала,
отношением к температуре и рН, и некоторыми
другими показателями. На использовании
препаратов грибной глюкоамилазы
разработан ферментативный метод
получения глюкозы, который получил
широкое распространение в Японии.
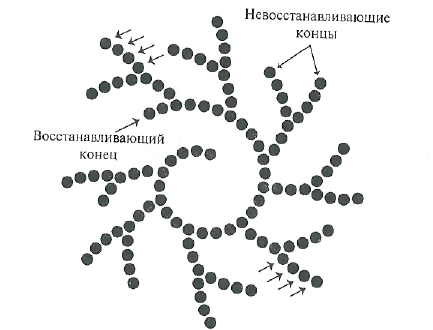
Пуллуланаза(И.Ф. 3.2.1.41). Ранее этот фермент был известен под другими названиями — К-фермент, предельная декстриназа, дебранчинг-фермент.
Пуллуланаза является эндогенным ферментом, она способна хаотично гидролизовать а-1,6-гликозидные связи в пуллулане, амилопектине, гликогене и предельных декстринах, которые получаются при совместном воздействии на крахмал и гликоген а- и (3-амилаз. Наиболее частым отцепляемым фрагментом является мальтотриоза. На представленной ниже схеме действие пуллулоназы на пуллулан показано стрелками.
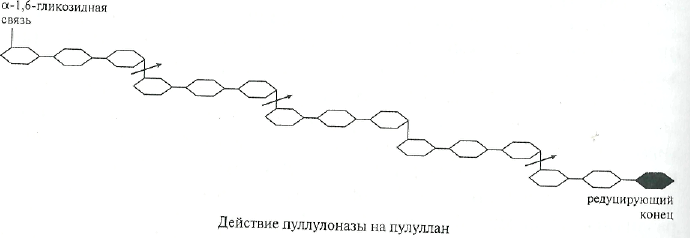
Продуцетами пуллуланазы являются АегоЬастег аего^епез, ВасШиз сегеш, ВасШиз роНтуха, ВасШиз кр. и ЗтгерЮтусез. Ферменты, полученные из различных источников, обладают разной молекулярной массой 310
