- •Е.В.Михеева, н.П.Пикула, м.И.Тартынова физическая химия
- •Введение
- •1. Химическая термодинамика Основные понятия химической термодинамики
- •Первое начало термодинамики
- •Формулировки первого начала термодинамики
- •Вычисление работы расширения идеальных газов в термодинамических процессах
- •Термохимия. Закон Гесса
- •Условия выполнения закона Гесса
- •Термодинамическое обоснование закона Гесса
- •Связь между Qp и qv
- •Следствия из закона Гесса. Методы расчета тепловых эффектов химических реакций
- •1. Расчет по стандартным теплотам образования
- •2. Расчет по стандартным теплотам сгорания
- •Метод термохимических уравнений
- •4. Метод термохимических схем
- •Теплоемкость
- •Теплоемкость идеального газа
- •Теплоемкость жидких и твердых тел
- •Эмпирические правила расчета теплоемкости
- •Влияние температуры на теплоемкость
- •Зависимость теплового эффекта химической реакции от температуры. Закон Кирхгофа
- •Исследование уравнения Кирхгофа
- •Расчет тепловых эффектов химических реакций по уравнению Кирхгофа
- •Второе начало термодинамики
- •Основные понятия и определения
- •Второе начало термодинамики. Энтропия
- •Формулировки второго начала термодинамики
- •Физический смысл энтропии
- •Статистическая природа второго начала термодинамики
- •Математическая запись второго начала термодинамики для обратимых процессов
- •Математическая запись второго начала термодинамики для необратимых процессов
- •Изменение энтропии как критерий направления процесса в изолированной системе
- •Расчет изменения энтропии в различных процессах
- •6. Расчет изменения энтропии для химической реакции по значениям стандартных абсолютных энтропий
- •Термодинамические потенциалы
- •Энергия Гиббса Физический смысл энергии Гиббса
- •Энергия Гиббса как критерий направления процесса
- •Расчет изменения энергии Гиббса в различных процессах
- •Энергия Гельмгольца Физический смысл энергии Гельмгольца
- •Энергия Гельмгольца как критерий направления процесса
- •Расчет изменения энергии Гельмгольца в различных процессах
- •1. Расчет изменения энергии Гельмгольца в изотермическом процессе расширения или сжатия n моль идеального газа
- •2. Расчет изменения энергии Гельмгольца в изотермическом процессе расширения или сжатия жидких и твердых тел
- •3. Расчет изменения энергии Гельмгольца в обратимо работающем электрохимическом элементе
- •Характеристические функции. Уравнения Гиббса – Гельмгольца
- •Химический потенциал
- •Условие равновесия в системе с переменным числом моль
- •Зависимость химического потенциала от давления
- •1. Область малых давлений (идеальный газ)
- •2. Область высоких давлений (реальные газы)
- •2. Химическое равновесие
- •Закон действующих масс
- •Уравнение изотермы химической реакции
- •Определение направления процесса по изотерме химической реакции
- •Уравнение химического сродства. Стандартная энергия Гиббса реакции
- •Различные способы выражения константы равновесия
- •Зависимость константы равновесия от температуры
- •Интегрирование уравнения изобары химической реакции
- •Влияние давления и температуры на химическое равновесие. Принцип Ле-Шателье
- •1. Влияние давления на смещение химического равновесия
- •2. Влияние температуры на равновесие химической реакции
- •Гетерогенное химическое равновесие
- •Расчет химического равновесия. Термическая диссоциация
- •3. Фазовое равновесие Основные понятия и определения
- •Основной закон фазового равновесия. Правило фаз Гиббса
- •Фазовое равновесие в однокомпонентной системе. Диаграммы состояния однокомпонентных систем
- •Уравнение Клапейрона - Клаузиуса
- •Применение уравнения Клапейрона – Клаузиуса к процессам испарения и возгонки
- •Расчет теплоты испарения и возгонки по уравнению Клапейрона – Клаузиуса
- •Однокомпонентные гетерогенные системы
- •Диаграмма состояния воды
- •Диаграмма состояния серы
- •Фазовое равновесие в двухкомпонентной системе. Диаграммы состояния двухкомпонентных систем Физико-химический анализ. Термический анализ
- •Фазовые диаграммы состояния двухкомпонентных систем
- •Диаграмма состояния системы с эвтектикой
- •Определение количественных соотношений между фазами. Правило рычага
- •Химические соединения
- •Фазовая диаграмма с конгруэнтно плавящимся химическим соединением
- •Фазовая диаграмма с инконгруэнтно плавящимся химическим соединением
- •Твердые растворы
- •Фазовая диаграмма с неограниченной растворимостью компонентов в твердом состоянии
- •Фазовые диаграммы с ограниченной растворимостью компонентов в твердом состоянии
- •Диаграммы состояния с ограниченной растворимостью компонентов с эвтектикой (I типа)
- •Диаграммы состояния с ограниченной растворимостью компонентов с перитектикой (II типа)
- •Диаграммы состояния эвтектического типа с полиморфизмом компонентов
- •Сложные диаграммы состояния Диаграмма плавкости системы Al – Ni
- •Диаграмма состояния системы Fe-Fe3c
- •4. Растворы Общая характеристика растворов
- •Различные способы выражения концентрации растворов
- •Парциальные молярные величины и их значение в термодинамике растворов
- •Основные соотношения между парциальными молярными величинами
- •Аддитивные и неаддитивные свойства растворов
- •Типы растворов
- •Идеальные растворы
- •Предельно разбавленные растворы
- •Неидеальные растворы
- •Давление насыщенного пара компонента над раствором
- •Повышение температуры кипения растворов нелетучих веществ
- •Понижение температуры замерзания растворов нелетучих веществ
- •Осмотическое давление раствора
- •5. Электрохимия
- •Константа диссоциации слабого электролита
- •Ионное произведение воды. РН раствора
- •Сильные электролиты
- •Электрическая проводимость растворов электролитов
- •Кондуктометрия
- •Электролиз
- •Правила записи реакций на электродах при электролизе
- •Законы Фарадея
- •Числа переноса
- •Электродвижущие силы электрохимических элементов Основные понятия и определения
- •Правила записи электрохимических элементов
- •Электродные потенциалы
- •Типы электродов
- •Электроды первого рода
- •Электроды второго рода
- •Связь между электродами первого и второго рода
- •Окислительно-восстановительные электроды
- •Электрохимические элементы
- •Химические цепи
- •Химические цепи с двумя электролитами
- •Химические цепи с одним электролитом
- •Концентрационные цепи
- •Концентрационные цепи без переноса ионов
- •Концентрационные цепи c переносом ионов
- •6. Химическая кинетика
- •Основные понятия химической кинетики
- •Скорость химической реакции
- •Закон действующих масс
- •Формальная кинетика
- •Решение кинетических задач методами формальной кинетики
- •Односторонние реакции первого порядка
- •Односторонние реакции второго порядка
- •Односторонние реакции третьего порядка
- •Зависимость скорости реакции от температуры
- •Методы определения энергии активации
- •Теории химической кинетики
- •Теория активных столкновений
- •Теория активированного комплекса
- •7. Катализ Основные понятия. Основные свойства катализатора
- •Гомогенный катализ
- •Гетерогенный катализ
- •8. Дисперсные системы Основные понятия и определения
- •Признаки объектов коллоидной химии
- •Специфические особенности высокодисперсных систем
- •Классификации дисперсных систем
- •1. Классификация по размерам частиц дисперсной фазы
- •2. Классификация по агрегатному состоянию дисперсной фазы и дисперсионной среды.
- •9. Поверхностные явления Термодинамика поверхностных явлений
- •Поверхностное натяжение Физический смысл поверхностного натяжения
- •Термодинамическое определение поверхностного натяжения
- •Влияние температуры
- •Влияние природы граничащих фаз
- •Смачивание
- •Анализ уравнения Юнга
- •Флотация
- •Особенности искривленной поверхности раздела фаз
- •Капиллярное давление. Течение жидкости в капиллярах
- •Анализ уравнения Жюрена
- •Адсорбция Основные понятия и определения
- •Классификации адсорбции
- •1. Классификация по природе границы раздела
- •2.Классификация по типу взаимодействия адсорбата и адсорбента
- •Основные характеристики адсорбции
- •Основные экспериментальные зависимости адсорбции
- •Адсорбция на границе твердое тело – газ Теория мономолекулярной адсорбции Лэнгмюра Основные положения
- •Расчет констант уравнения Лэнгмюра
- •Адсорбция на границе жидкость – газ Особенность границы раздела жидкой и газообразной фаз
- •Фундаментальное уравнение адсорбции Гиббса
- •Свойства поверхностно-активных (пав) и поверхностно-инактивных (пив) веществ
- •Строение адсорбционного слоя на границе раствор - газ
- •Перечень используемой литературы
- •Содержание
Математическая запись второго начала термодинамики для обратимых процессов
Для обратимо протекающих процессов математическая запись второго начала термодинамики записывается в виде:
![]() , (1.53)
, (1.53)
где
![]() – приведенная теплота.
– приведенная теплота.
Для обратимых процессов в изолированной системе энтропия является постоянной величиной:
![]() . (1.54)
. (1.54)
Таким образом, для обратимых процессов второе начало термодинамики выступает как закон о существовании и сохранении энтропии.
Энтропия – функция состояния системы, ее изменение не зависит от пути процесса, а зависит только от начального и конечного состояния системы.
Энтропия – величина аддитивная. Энтропия равновесной системы равна сумме энтропий отдельных ее частей, а изменение энтропии всей системы равно сумме изменений энтропий ее частей. Изменение энтропии в сложном процессе равно сумме изменений энтропий в отдельных стадиях процесса:
ΔSпроцесса = ΔS1 + ΔS2 + ΔS3. (1.55)
Математическая запись второго начала термодинамики для необратимых процессов
Для необратимо протекающих процессов следствием второго начала термодинамики являются неравенства:
![]() . (1.56)
. (1.56)
Так как теплота в необратимом процессе меньше, чем в обратимом, то математическая запись второго начала термодинамики имеет вид:
![]() . (1.57)
. (1.57)
Для необратимых самопроизвольных процессов в изолированной системе:
![]() . (1.58)
. (1.58)
Таким образом, для необратимых процессов второе начало термодинамики выступает как закон о существовании и возрастании энтропии.
Для обратимых и необратимых процессов математическая запись второго начала термодинамики имеет вид:
![]() или
или
![]() . (1.59)
. (1.59)
Знак равенства соответствует обратимым процессам, знак неравенства – необратимым.
Для изолированных систем:
![]() . (1.60)
. (1.60)
Таким образом, в изолированных системах самопроизвольно могут совершаться лишь такие процессы, в результате которых энтропия системы возрастает; процесс идет до тех пор, пока энтропия не достигнет максимального для данных условий значения.
Подставляя вместо δQ выражение из первого начала термодинамики, получим объединенное уравнение первого и второго начал термодинамики:
![]() . (1.61)
. (1.61)
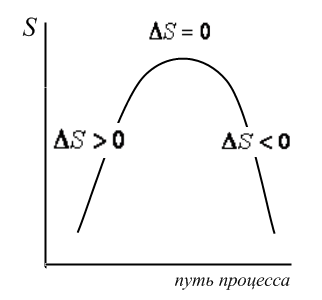
Изменение энтропии как критерий направления процесса в изолированной системе
Изменение энтропии является критерием направления процесса в изолированной системе. Изолированная система имеет постоянную внутреннюю энергию и постоянный объем (U, V=const).
Рис.1.3. Изменение энтропии при протекании процесса |
Если
Если
Если
|
Расчет изменения энтропии в различных процессах
Большинство реальных процессов необратимо, то есть рассчитать энтропию нельзя.
Так как энтропия является функцией состояния системы, то ее изменение в обратимом и необратимом процессе одинаково. Для вычисления изменения энтропии в данном реальном необратимом процессе, этот процесс (мысленно) разбивают на стадии, которые проводятся обратимо и вычисляют для них изменение энтропии для обратимых процессов, суммируют изменение энтропии всех обратимых стадий и получают изменение энтропии в данном необратимом процессе.
Например, для расчета изменения энтропии в необратимом процессе нагревания льда, находящегося при Т= –10°С до состояния жидкой воды при Т=10°С (ΔSпроц), процесс разбиваем на три обратимые стадии: стадию нагревание льда от Т= –10°С до Т=0°С (ΔS1); стадию фазового перехода – плавления льда (ΔS2); стадию нагревания воды от Т=0°С до Т=10°С (ΔS3), тогда: ΔSпроцесса = ΔS1 + ΔS2 + ΔS3.
ΔSпроц
H 2O(тв)(Т=-10°С)
H2O(ж)(Т=10°С)
2O(тв)(Т=-10°С)
H2O(ж)(Т=10°С)




ΔS1 нагревание нагревание ΔS3
ΔS2

 H2O(тв)(Т=0°С)
H2O(ж)(Т=0°С)
H2O(тв)(Т=0°С)
H2O(ж)(Т=0°С)
фазовый переход
Рассмотрим, как рассчитывается энтропия в различных процессах.
1. Расчет изменения энтропии в процессе фазового перехода
Процессы фазового перехода (плавление, испарение, возгонка) проходят при постоянной температуре (Т=const). Изменение энтропии рассчитывают по уравнениям:
![]() ; (1.62)
; (1.62)
![]() , (1.63)
, (1.63)
где ΔUф.п. и ΔНф.п. – теплоты фазового перехода, Т – абсолютная температура фазового перехода, n – число моль.
2. Расчет изменения энтропии при нагревании жидких или твердых тел от Т1 до Т2
а) процесс протекает при постоянном объеме и теплоемкости (V, CV = const):
![]() , (1.64)
, (1.64)
б) процесс протекает при постоянном давлении и теплоемкости (р, Cр = const):
![]() , (1.65)
, (1.65)
в) процесс протекает при постоянном давлении (р = const), теплоемкость зависит от температуры (Cр = а+bT+cT2):
![]() . (1.66)
. (1.66)
3. Расчет изменения энтропии при нагревание идеального газа от Т1 до Т2
а) процесс протекает при постоянной теплоемкости газа (CV = const):
![]() , (1.67)
, (1.67)
б) при протекании процесса теплоемкость зависит от температуры (CV = а+bT+cT2):
![]() . (1.68)
. (1.68)
4. Расчет изменения энтропии при взаимной диффузии газов
Изменение энтропии при взаимной диффузии двух идеальных газов с образованием 1 моль смеси газов рассчитывается по уравнению:
![]() , (1.69)
, (1.69)
где х – мольная доля газа в смеси:
![]() ;
;
![]() . (1.70)
. (1.70)
5. Расчет изменения энтропии в обратимо работающем электрохимическом элементе
Изменение энтропии при необратимой химической реакции, протекающей при постоянном давлении и температуре, например, в обратимо работающем электрохимическом элементе рассчитывается по уравнению:
![]() , (1.71)
, (1.71)
где
ΔН
– тепловой эффект химической реакции;
![]() – максимально полезная работа химической
реакции, то есть работа химической
реакции, которую можно определить,
например, по ЭДС обратимо работающего
электрохимического элемента (
– максимально полезная работа химической
реакции, то есть работа химической
реакции, которую можно определить,
например, по ЭДС обратимо работающего
электрохимического элемента (![]() );
z
– число электронов, участвующих в
электродной реакции на одну реагирующую
частицу; F
– постоянная
Фарадея, равная 96500 Кл; Е
– электродвижущая сила электрохимического
элемента.
);
z
– число электронов, участвующих в
электродной реакции на одну реагирующую
частицу; F
– постоянная
Фарадея, равная 96500 Кл; Е
– электродвижущая сила электрохимического
элемента.