
- •Тема 2.1.
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи добування колоїдних систем
- •Методи диспергування
- •4. Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Контрольні запитання
- •Тема 2.2.
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Контрольні запитання
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Тим, хто хоче знати більше значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Контрольні запитання
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Тим, хто хоче знати більше роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Контрольні запитання
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •2.2. Класифікація емульсій
- •2.3.Утворення емульсій
- •2.4.Стійкість емульсій
- •2.5.Руйнування емульсій
- •2.6. Практичне значення емульсій
- •Піни, їх будова і стійкість
- •3.1.Будова пін та їх визначення
- •3.2. Одержання пін
- •3.3. Характеристика піноутворювачів та їх значення
- •3.4. Застосування пін
- •3.5. Руйнування пін
- •Аерозолі та їх властивості
- •4.1.Класифікація аерозолів
- •Розміри частинок димів і туманів
- •4.2. Методи одержання аерозолів
- •4.3. Властивості аерозолів
- •4.4. Аерозолі в народному господарстві, природі та техніці
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •5.1. Визначення порошків та їх розміри
- •5.2. Методи одержання порошків
- •5.3. Особливості порошків
- •5.4. Властивості порошків
- •Контрольні запитання
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •Драглі, їх утворення
- •Тим, хто хоче знати більше характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Контрольні запитання
- •Література
2. Дифузійно-седиментаційна рівновага
На колоїдні частинки, розподілені в дисперсійному середовищі, діють дві протилежно направлені сили. Під дією сили тяжіння частинки намагаються осісти на дно - седиментувати.
Седиментація – процес осідання частинок дисперсної фази під дією сили тяжіння.
Сили дифузії, навпаки, намагаються розподілити частинки рівномірно по всьому об'єму системи. Під дією сил дифузії частинки диспергованої речовини намагаються переміститися з області більших в область менших концентрацій. Внаслідок цього в системі встановиться певне рівноважне розподілення частинок по висоті - дифузійно-седиментаційна рівновага.
Седиментаційна стійкість – здатність дисперсних систем зберігати певний розподіл частинок по об’єму дисперсійного середовища.
Седиментаційна рівновага властива частинкам колоїдної дисперсності, для яких сила тяжіння врівноважується дифузією. При цьому:
швидкість седиментації дорівнює швидкості дифузії, коли через одиницю поверхні перерізу в одиницю часу проходить вниз стільки ж осідаючих частинок, скільки їх проходить вгору за рахунок дифузії.
Рівномірний розподіл частинок в колоїдних системах, особливо у високодисперсних, досягається досить повільно, але легко руйнується при струшуванні, поштовхах, під дією концентраційних потоків.
Грубодисперсні системи седиментаційно нестійкі, їх частинки осідають під дією сили тяжіння. Молекулярні системи (гази, розчини) володіють досить високою седиментаційною стійкістю.
Седиментаційна стійкість колоїдних систем залежить від розмірів їх частинок: чим менший розмір частинок, тим більш стійкий колоїдний розчин.
3. Oптичні властивості колоїдних систем
Важливу роль відіграють дослідження оптичних властивостей дисперсних систем, що дозволили закласти основи їх класифікації, виявити природу колоїдних розчинів, визначити розміри і форми дисперсних частинок, розробити досконалі фізико-хімісні методи досліджень.
Оптичні властивості колоїдних систем визначаються взаємодією світла з частинками дисперсної фази. При проходженні світла через дисперсну систему воно може поглинатися, відбиватися або розсіюватися частинками.
Відбивання світла поверхнею частинок можливе тільки в грубодисперсних системах (суспензіях, емульсіях). Розміри частинок таких систем значно більші, ніж довжина хвилі видимого світла. Відбивання світла проявляється в помутнінні дисперсних систем і спостерігається як в прямому світлі, так і при боковому освітленні.
Відбиття світла має місце, якщо довжина хвилі світла λ менша за радіус частинки r: λ < r, колір проміння при цьому не змінюється. Таке явище спостерігається, наприклад, при осіданні піску у воді, якщо на воду падають сонячні промені чи промені іншого джерела світла. Такі грубодисперсні системи каламутні і при стоянні розшаровуються.
Часткове поглинання світла відбувається, коли довжина хвилі значно більша за радіус частинок: λ >> r. Поглинання світла це явище вибіркове. Одні речовини постійно поглинають світло, інші поглинають лише промені певної частини спектру. Поглинання світла властиво будь-яким дисперсним системам.
Найбільш характерною оптичною властивістю для типових колоїдних систем є розсіювання світла в усіх напрямках. Частинки колоїдної дисперсності менші довжини півхвилі світла і тому розсіювання світла обумовлено не відбиванням світла від поверхні частинок, а його дифракцію. Розсіювання світла спостерігається, коли довжина хвилі світла сумірна з радіусами частинок дисперсної фази: λ ≥ r
Якщо пучок світла падає на поверхню будь-якої частинки, лінійні розміри якої більші, ніж довжина хвилі падаючого на неї світла, то відбувається відбивання світла. При цьому частина світла може проникнути у середину частинки, зазнавати заломлення, внутрішнього відбивання і поглинання. Якщо частинки мають розміри, менші половини довжини хвилі падаючого світла, його відбивання від площини частинки в певних напрямках не відбувається, світло розсіюється за всіма напрямками, огинаючи частинки (явище дифракції).
На відміну від грубодисперсних суспензій, колоїдні розчини у світлі, що проходить через них, зовсім прозорі. Однак, якщо колоїдну систему спостерігати збоку, то можна помітити, що в освітленій частині розчин наче мутніє.
Розсіювання світла було досліджено Тиндалем (англ.). При проходженні світлового пучка через колоїдний розчин спостерігається конус, який світиться. Це явище одержало назву «конус Тиндаля», або ефект Тиндаля.
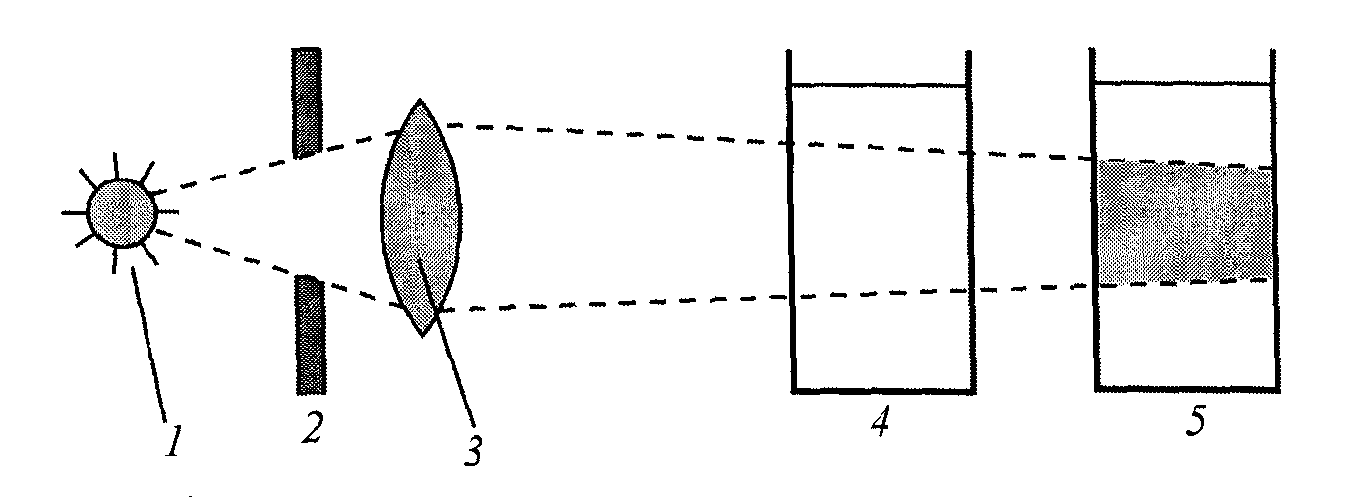
Рис.7. Ефект Тиндаля:
1 – джерело світла; 2 – діафрагма; 3 – оптична лінза; 4 – водний розчин NaCl; 5 – колоїдний розчин.
При освітленні колоїдного розчину яскравим світлом промінням шлях його видно при спостереженні збоку у вигляді конуса, що світиться.
При спостереженні за колоїдним розчином при боковому освітленні спостерігається голубувате світіння. Це світіння називається опалесценцією.
Опалесценція – дифракційне розсіювання світла в колоїдних системах, яке супроводжується зміною кольору.
Ця назва походить від мінералу опала молочно-голубуватої або жовтувато-білого забарвлення.
Якщо золь має забарвлення, його кольори в прямому і розсіяному світлі є різними. Таке явище називають дихроїзмом (від грецького слова – двобарвний).
В істинних розчинах, нехай навіть забарвлених, розсіювання світла не виявляється. Тому за допомогою явища Тиндаля можна легко відрізнити істинний розчин від колоїдного (рис.7).
Теоретичне обгрунтування світлорозсіювання дано Релей, який вивів рівняння:
Ip
= 24
![]() Io
Io
 2
2
![]()
![]()
де Ір - інтенсивність світла, розсіяного одиницею об'єму Золя;
І0 - інтенсивність падаючого світла;
n1, n2 - показники заломлення дисперсної фази і дисперсійного середовища;
ν - часткова (або чисельна) концентрація, тобто число частинок в одиниці об'єму;
V - об'єм однієї частинки;
![]() - довжина
світлової хвилі.
- довжина
світлової хвилі.
Рівняння Релея застосовують для частинок, діаметр яких не перевищує 5∙10-8м, тобто для частинок типово колоїдних розмірів.
Згідно цього рівняння інтенсивність розсіяного світла збільшується із збільшенням різниці між показниками заломлення n1 і n2 . З цього ж рівняння видно, що інтенсивність розсіювання світла обернено пропорційна 4 степені довжини хвилі. Якщо падаюче світло поліхроматичне (біле), то розсіяне світло повинно бути багатшим короткими хвилями, тобто при боковому освітлені безкольорні колоїдні розчини мають синювате забарвлення. А в світлі, що проходить крізь них, вони здаються забарвленими в червоний колір. Таке забарвлення мають золі сірки, хлористого срібла, каніфолі та інші безбарвні колоїдні розчини.
Розсіювання світла відбувається не тільки в рідких золях, хмарах і туманах. Розсіювання сонячних хвиль є і в атмосфері, що оточує Землю.
Відбувається воно на мікрочастинках пилу і диму, мікрокрапельках вологи завдяки флуктуації густини газів. Підвищеним розсіюванням короткохвильових променів в атмосфері пояснюється блакитний колір неба, а також червоний колір сонця, що сходить чи заходить (рис.8)
 Рис.8.
Схема, що пояснює забарвлення атмосфери.
Рис.8.
Схема, що пояснює забарвлення атмосфери.
На інтенсивному розсіюванні промінь короткохвильової частини спектра засноване застосування ламп синього світла для світломаскування і червоного світла для сигналів небезпеки. Сині промені при проходженні через шар повітря, що містить частинки пилу, диму або туману, повністю розсіюються. Червоні ж промені розсіюються в значно меншій степені і червоний сигнал видно на великій відстані. У червоний або оранжевий колір забарвлюють рятувальні засоби, жорожні знаки тощо. Нарешті ще один приклад. Вміст коротких ультрафіолетових променів високо в горах більший, ніж на рівні моря. Це суттєво впливає на фауну і флору.
