
- •Тема 2.1.
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи добування колоїдних систем
- •Методи диспергування
- •4. Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Контрольні запитання
- •Тема 2.2.
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Контрольні запитання
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Тим, хто хоче знати більше значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Контрольні запитання
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Тим, хто хоче знати більше роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Контрольні запитання
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •2.2. Класифікація емульсій
- •2.3.Утворення емульсій
- •2.4.Стійкість емульсій
- •2.5.Руйнування емульсій
- •2.6. Практичне значення емульсій
- •Піни, їх будова і стійкість
- •3.1.Будова пін та їх визначення
- •3.2. Одержання пін
- •3.3. Характеристика піноутворювачів та їх значення
- •3.4. Застосування пін
- •3.5. Руйнування пін
- •Аерозолі та їх властивості
- •4.1.Класифікація аерозолів
- •Розміри частинок димів і туманів
- •4.2. Методи одержання аерозолів
- •4.3. Властивості аерозолів
- •4.4. Аерозолі в народному господарстві, природі та техніці
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •5.1. Визначення порошків та їх розміри
- •5.2. Методи одержання порошків
- •5.3. Особливості порошків
- •5.4. Властивості порошків
- •Контрольні запитання
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •Драглі, їх утворення
- •Тим, хто хоче знати більше характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Контрольні запитання
- •Література
6. Іонообмінна адсорбція
Адсорбція іонів залежить від їх природи – заряду, радіусу, ступеня гідратації. Чим більше заряд іона, тим краще він адсорбується. Із іонів з однаковими зарядами краще адсорбується іон, який має найбільший радіус, так як він має найменший ступінь гідратації. Гідратна оболонка запобігає адсорбції, тому чим менший ступінь гідратації, тим іон краще адсорбується.
Правило Фаянса-Панетта:
На поверхні кристалічного твердого тіла із розчину адсорбується той з іонів, який входить до складу кристалічної гратки або може утворювати з одним з іонів гратки малорозчинну сполуку.
Іони в розчинах електролітів здатні до іонообмінної адсорбції.
Іонообмінна адсорбція – процес обміну іонів між розчином і твердою фазою – адсорбентом.
При цьому тверда фаза поглинає з розчину іони одного знаку (катіони або аніони) і замість них виділяє в розчин еквівалентну кількість інших іонів цього ж заряду. Такий обмінний іонний процес аналогічний реакціям іонного обміну в розчинах електролітів, але він відбувається на поверхні твердої фази.
Іоніти – речовини, здатні до іонообмінного обміну.
В залежності від того, який вид іонів приймає участь в обміні, іоніти поділяють на катіоніти та аніоніти. Катіоніти здатні обмінюватись катіонами, в тому числі і іон Н+; аніоніти – аніонами, в тому числі ОН-. Обмінна адсорбція іонів відбувається повільніше, ніж молекулярна.
Р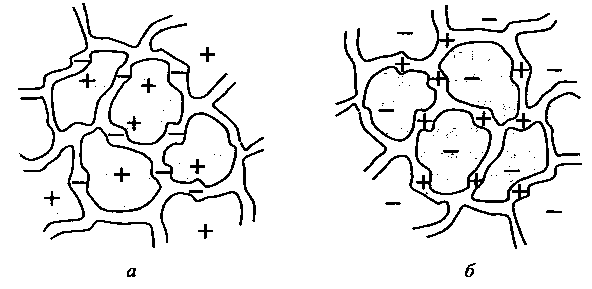 ис.18.
Схематичне зображення іоніту:
ис.18.
Схематичне зображення іоніту:
а – катіоніт;
б – аніоніт.
Іоніти класифікують за походженням на природні і синтетичні, а також за складом – на неорганічні та органічні. До природних неорганічних іонітів належать силікати типу цеолітів: глауконіт, клиноптилоліт, шабазит тощо. До природних органічних іонітів належать гумусові речовини, що знаходяться в ґрунті. Синтетичні неорганічні іоніти одержують на основі комплексних сполук сурми, фосфору, цирконію та інших елементів.
Практичне використання іонного обміну значно поширилося після розробки синтетичних смол-іонітів, які вперше були синтезовані Адамсом і Холмсом у 1934р. Ці іонообмінні смоли мають такі переваги:
висока поглинальна ємність,
хімічна стійкість, в тому числі до концентрованих розчинів сильних кислот і лугів,
механічна міцність гранул іонітів,
вибірковість дії,
можливість багаторазової регенерації.
Іонообмінна адсорбція широко застосовується для добування демінералізованої води, тобто води, що не містить розчинених солей. Для повного позбавлення води від іонів, її послідовно пропускають через катіонів та аніонів фільтри. Промислові іоніти мають високу механічну і хімічну стійкість, вони витримують сотні регенераційних циклів.
Іоніти застосовують для очищення промислових вод від іонів важких металів (Хрому, Купруму, Плюмбуму). У цукровій промисловості іоніти застосовують для очищення дифузного соку від електролітів – патокоутворювачів, дозволяє підвищити вихід цукру.
У молочній промисловості іоніти використовують для часткового видалення із молока Са2+ і Мg2+ іонів з заміною їх на іони Na+ і К+. Таке молоко називається іонітним і використовується для годування немовлят.
За допомогою аніонітної обробки фруктові соки позбавляють зайвої кислотності, яка надає їм неприємного смаку.
У сучасній медицині іонний обмін використовують при захворюваннях, пов’язаних з порушеннями іонного балансу в органах і тканинах (виразка шлунку, гіпертонічні набряки тощо): змістити іонний баланс організму вдається введенням високодисперсних порошків із іонообмінних смол.
Іонообмінна адсорбція має велике значення для землеробства, бо від природи поглинутих грунтом катіонів залежить їх родючість. До обміну іонів здатні не тільки грунти, але й ряд природних речовин, наприклад, силікати.
Іоніти знайшли також широке застосування для очистки промислових стічних вод.
