
- •Тема 2.1.
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи добування колоїдних систем
- •Методи диспергування
- •4. Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Контрольні запитання
- •Тема 2.2.
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Контрольні запитання
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Тим, хто хоче знати більше значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Контрольні запитання
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Тим, хто хоче знати більше роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Контрольні запитання
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •2.2. Класифікація емульсій
- •2.3.Утворення емульсій
- •2.4.Стійкість емульсій
- •2.5.Руйнування емульсій
- •2.6. Практичне значення емульсій
- •Піни, їх будова і стійкість
- •3.1.Будова пін та їх визначення
- •3.2. Одержання пін
- •3.3. Характеристика піноутворювачів та їх значення
- •3.4. Застосування пін
- •3.5. Руйнування пін
- •Аерозолі та їх властивості
- •4.1.Класифікація аерозолів
- •Розміри частинок димів і туманів
- •4.2. Методи одержання аерозолів
- •4.3. Властивості аерозолів
- •4.4. Аерозолі в народному господарстві, природі та техніці
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •5.1. Визначення порошків та їх розміри
- •5.2. Методи одержання порошків
- •5.3. Особливості порошків
- •5.4. Властивості порошків
- •Контрольні запитання
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •Драглі, їх утворення
- •Тим, хто хоче знати більше характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Контрольні запитання
- •Література
4. Капілярна конденсація
Конденсація - це фазовий перехід із стану газу в рідину, який відбувається для даної речовини за певних температури та тиску.
При цьому мається на увазі, що такий процес відбувається на площинній поверхні. При адсорбції в тонкопористих сорбентах за певного тиску газу в тонких порах починають перекриватися граничні шари адсорбованої речовини. Внаслідок цього утворюються ділянки з начебто об'ємною фазою.
Ц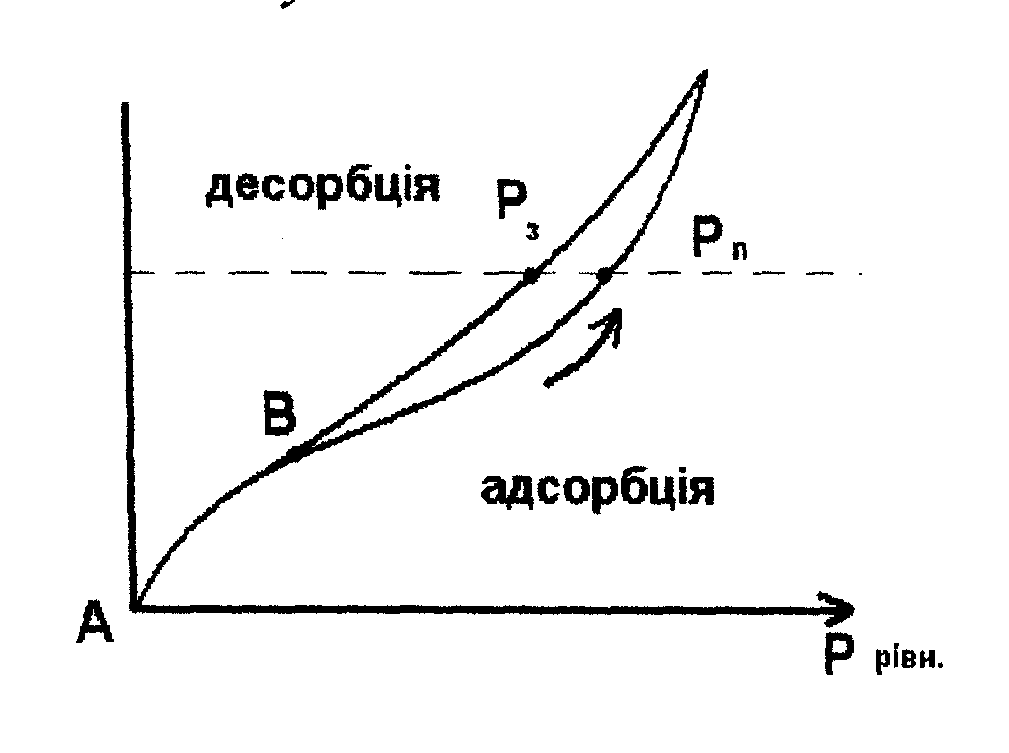 ей
процес
подібний капілярній
конденсації, але
відбувається він не на площині, а в
тонких
капілярах. З
іншого боку, конденсація в капілярах
мала би відбуватися за менших тисках
парів адсорбтиву, оскільки тиск пари
над площиною і в капілярах відрізняється
завдяки кривизні
меніска. Це
явище спричинює гістерезис
адсорбції, який проявляється в тому,
що крива адсорбції не співпадає з
кривою десорбції. На
pис.15 представлено ізотерми
адсорбції-десорбції води силікагелем.
Видно, що ізотерма обернена тільки на
ділянці АВ. Вище точки В вона стає не
оберненою - одній і тій самій величині
адсорбції відповідає тиск пари Рп
при поглинанні
вологи і тиск Р3
при неводненні,
причому рп>рз.
Отже, поява
гістерезису на адсорбційних кривих
відповідає наявності
капілярної конденсації в системі, а
також вказує на те, що досліджувана
система є тонкопористою.
ей
процес
подібний капілярній
конденсації, але
відбувається він не на площині, а в
тонких
капілярах. З
іншого боку, конденсація в капілярах
мала би відбуватися за менших тисках
парів адсорбтиву, оскільки тиск пари
над площиною і в капілярах відрізняється
завдяки кривизні
меніска. Це
явище спричинює гістерезис
адсорбції, який проявляється в тому,
що крива адсорбції не співпадає з
кривою десорбції. На
pис.15 представлено ізотерми
адсорбції-десорбції води силікагелем.
Видно, що ізотерма обернена тільки на
ділянці АВ. Вище точки В вона стає не
оберненою - одній і тій самій величині
адсорбції відповідає тиск пари Рп
при поглинанні
вологи і тиск Р3
при неводненні,
причому рп>рз.
Отже, поява
гістерезису на адсорбційних кривих
відповідає наявності
капілярної конденсації в системі, а
також вказує на те, що досліджувана
система є тонкопористою.
Рис.15. Ізотерми адсорбції-десорбції води силікагелем.
5. Молекулярна адсорбція з розчинів
Перші дослідження по адсорбції із розчинів належать російському вченому Т.Є.Ловицу (1785р., російський хімік і фармацевт). Він вперше запропонував застосувати активоване вугілля для очищення спирту від сивушних масел та питної води від різних речовин з неприємним запахом (дезодорація води).
Адсорбція із розчинів на твердому адсорбенті – більш складний процес, ніж адсорбція газів. Розчини є, як мінімум, двокомпонентними системами, що складається з розчиненої речовини і розчинника. Тому адсорбція з розчинів визначається не тільки силами взаємодії між молекулами розчиненої речовини і адсорбентом, але й взаємодією розчинник – адсорбент і розчинник – розчинена речовина. Якщо розчинена речовина представляє собою електрліт, то процес адсорбції ускладнюється ще й тим, що в цьому випадку адсорбуються іони, які несуть електричний заряд.
Особливості адсорбції розчинених речовин із розчинів:
Процеси дифузії у розчинах відбуваються у сотні і тисячі разів повільніше, ніж у газах. Завдяки цьому адсорбційна рівновага в розчинах досягається лише через декілька годин або навіть діб. Для підвищення швидкості процесу адсорбенти часто розтирають до дрібного порошку і суспензію адсорбенту у розчині безперервно перемішують.
Разом із розчиненою речовиною відбувається адсорбція розчинника. Внаслідок цього між молекулами адсорбтива і розчинника відбувається своєрідна конкуренція за володіння поверхнею адсорбенту. Якщо розчинник погано змочує тверде тіло, він і адсорбується на ньому погано. Тому адсорбція розчинених у такому розчиннику речовин буде значною.
Адсорбція залежить від змочування розчинником адсорбенту.
Адсорбція іонів із розчинів електролітів має вибірковий характер.
Всі адсорбенти можна розподілити на два основних типи: гідрофільні (добре змочуються водою), гідрофобні (змочуються органічними розчинниками).
До гідрофільних адсорбентів належать: силікагель, глина, кізельгур, трепел. Ці адсорбенти доцільно застосовувати для адсорбції із неводних розчинів, наприклад, для очищення олій, нафтопродуктів, барвників. Але їх не потрібно застосовувати при адсорбції розчинених речовин з водних розчинів, бо вони краще адсорбують розчинник – воду. Ці адсорбенти доцільніше використовувати при адсорбенції з неводних розчинів.
Гідрофобні адсорбенти – активоване вугілля, графіт, тальк – добре адсорбують речовини із водних розчинів. Їх застосовують у виробництві спирту. У цукровій і крохмалопатоковій промисловості за допомогою активованого вугілля знебарвлюють цукрові та глюкозні сиропи. Активоване вугілля застосовують для очищення питної води, а також в медицині для зв’язування отрут, що попали в шлунково-кишковий тракт.
Органічні сорбенти природного походження представляють головним чином вуглеводи: крохмаль (картопляний, кукурудзяний, рисовий) та целюлоза.
Адсорбція молекулярно розчиненої речовини в залежності від рівноважної концентрації характеризується звичайною (як і для газів) ізотермою адсорбції. Ізотерма адсорбції з розбавлених розчинів добре описується рівнянням Фрейндліха або рівнянням Люнгмюра:
![]() або Г = Гмакс
або Г = Гмакс
![]()
де с – рівноважна концентрація речовини в розчині.
На відміну від адсорбції газів при адсорбції з розчинів рівновага наступає не так швидко, особливо на мілкопорістих адсорбентах. Перемішування розчину мало впливає на швидкість досягнення рівноваги, бо вона визначається, головним чином, швидкістю дифузії молекул розчиненої речовини в пори адсорбента.
Підвищення температури викликає зниження адсорбенції з розчинів, але в значно меншій степені, ніж адсорбцію газів.
Великий вплив на адсорбцію з розчинів має природа адсорбента, розчинника і розчиненої речовини.
Адсорбція розчинених речовин твердими адсорбентами підпорядковується правилу вирівнювання полярностей Ребіндера:
Чим ближче за своєю природою адсорбент до розчинника, тим менше адсорбується розчинена речовина з цього розчинника.
З величинами поверхневого натягу пов’язане явище змочування. Змочування визначається співвідношенням сил взаємодії між атомами на поверхні твердого тіла та молекулами рідини, з одного боку, та між молекулами самої рідини – з іншого боку. Змочування характеризується величиною крайового кута, який утворюється з площиною (рис.13). При певному змочуванні цей кут дорівнює нулю.

Рис.16. Змочування водою гідрофільної (а) і гідрофобної (б) поверхні твердого тіла.
Природу твердої поверхні адсорбенту можна змінити: гідрофільну поверхню зробити гідрофобною, а гідрофобну – гідрофільною. Для цього на твердій поверхні створюють адсорбційний шар ПАР (мила, жирні кислоти). Якщо гідрофільну поверхню обробити розчином якої-небудь жирної кислоти, то молекули кислоти адсорбуючись на такій поверхні утворюють орієнтований шар, в якому полярні групи молекул спрямовані до поверхні матеріалу, вуглеводневий радикал – до повітря. Поверхня речовини набуває гідрофобних властивостей. Краплі води на такій поверхні не змочуються. Це застосовують при обробці приладів жировими речовинами; для позбавлення від присипання в кулінарії, у кондитерському виробництві, при випіканні хліба. У сучасному посуді застосовують тефлонові покриття, які є гідрофобним матеріалом.
Іноді, навпаки, гідрофобній поверхні надають властивостей гідрофільності. Наприклад, при обробці милами та синтетичними миючими засобами, посуд набуває гідрофільних властивостей.
Велике значення для адсорбції має пористість адсорбента. Чим вона вища, тобто чим менше пори, тим більша питома поверхня сорбента і більша його адсорбційна активність. Але це справедливо тільки в тому випадку, якщо молекули розчиненої речовини по розмірам невеликі і можуть легко проникати в пори адсорбента. Із збільшенням пористості адсорбента збільшується число вузьких пор і крупні молекули адсорбтива не можуть проникнути в них. В цьому випадку збільшення пористості веде до зменшення адсорбції.

Рис.17. Профіль поверхні твердого адсорбента. Виступаючі ділянки – активні центри.
В зв’язку з тим, що адсорбція протікає на поверхні адсорбента, велике значення має поверхні адсорбента. Чим більша його поверхня, тим вища здатність до адсорбції. Крім того особливе значення мають при цьому нерівності поверхонь, бо на виступаючих ділянках твердого адсорбента («на активних центрах») адсорбція йде особливо сильно (рис.14). Так, виступи на часнинці вугілля в 4,5 рази інтенсивніше адсорбують кисень, чим западини на його поверхні.
На адсорбцію впливає також здатність розчинника розчиняти адсорбентив. Чим краще розчинник розчиняє адсорбтив, тим адсорбція із розчину йде гірше.
Адсорбція залежить і від будови молекул адсорбтива. Дифільні молекули розчиненої речовини при адсорбції, на твердому адсорбенті орієнтуються на його поверхні так, щоб полярна частина молекули була направлена до полярної фази, а неполярна – до неполярної.
Адсорбція широко використовується в харчовій технології: використання білків яєць та ікри для освітлення м’ясних та рибних бульйонів; очищення питної води, сиропів, соків при допомозі активованого вугілля. Явищем адсорбції пояснюється врахування товарного сусідства при зберіганні продуктів на складах та сховищах.
Важливу роль адсорбційні процеси грають в гетерогенному каталізі, при фарбуванні волокна, при збагаченні корисних копалин – флотації.
Флотація – метод збагачення руди, а також корисних копалин (вугілля, апатитів, сірки, графіту), що полягає в розділенні частинок цінного мінералу від пустої породи (частіше всього кварциту SiO2).
Миюча дія мила та інших миючих препаратів базується також на процесах адсорбції частинок.
