
- •Тема 2.1.
- •Загальні властивості дисперсних систем
- •Класифікація дисперсних систем
- •Класифікація по дисперсності
- •Класифікація за агрегатним станом фаз
- •Класифікація по міжфазній взаємодії
- •Методи одержання колоїдних систем
- •Методи добування колоїдних систем
- •Методи диспергування
- •4. Ознайомлення з методами очищення колоїдних систем
- •Застосування ультрафільтрації і зворотного осмосу в деяких галузях харчової промисловості
- •Контрольні запитання
- •Тема 2.2.
- •2. Дифузійно-седиментаційна рівновага
- •3. Oптичні властивості колоїдних систем
- •4.Оптичні методи досліджень колоїдних систем
- •Контрольні запитання
- •Тема: 2.3. Поверхневі явища і адсорбція план
- •Адсорбція , її види
- •2. Адсорбція на межі розчин – газ
- •3. Адсорбція на межі тверде тіло-газ
- •4. Капілярна конденсація
- •5. Молекулярна адсорбція з розчинів
- •Особливості адсорбції розчинених речовин із розчинів:
- •6. Іонообмінна адсорбція
- •7. Адсорбція з багатокомпонентних розчинів
- •8. Принцип хроматографічного аналізу
- •Тим, хто хоче знати більше значення сорбційних явищ
- •Шкідливість деяких поверхнево-активних речовин (пар)
- •Контрольні запитання
- •Тема 2.4. Електрокінетичні властивості, стабілізація і коагуляція золей план
- •Електрокінетичні явища
- •Будова міцели гідрозоля
- •Агрегативна стійкість золей
- •Коагуляція
- •5. Коагуляційні методи очищення промислових вод на підприємствах харчової промисловості
- •Тим, хто хоче знати більше роль процесів коагуляції при формуванні грунтів
- •Склад шампунів
- •Тема 2.5. Структуроутворення в дисперсних системах план
- •Вільнодисперсні та зв’язанодисперсні системи
- •2. Гелеутворення. Тиксотропія. Синерезис гелів
- •3. В’язкість дисперсних систем
- •4. Рівняння н’ютона та шведова-бінгама
- •5. Криві течії
- •Контрольні запитання
- •Тема 2.6 мікрогетерогенні і грубодисперсні системи
- •1. Суспензії, їх стабілізація
- •Характеристика суспензій
- •Одержання суспензій
- •Властивості суспензій
- •Застосування суспензій
- •Емульсії та їх одержання
- •Визначення емульсій та поширення в природі
- •2.2. Класифікація емульсій
- •2.3.Утворення емульсій
- •2.4.Стійкість емульсій
- •2.5.Руйнування емульсій
- •2.6. Практичне значення емульсій
- •Піни, їх будова і стійкість
- •3.1.Будова пін та їх визначення
- •3.2. Одержання пін
- •3.3. Характеристика піноутворювачів та їх значення
- •3.4. Застосування пін
- •3.5. Руйнування пін
- •Аерозолі та їх властивості
- •4.1.Класифікація аерозолів
- •Розміри частинок димів і туманів
- •4.2. Методи одержання аерозолів
- •4.3. Властивості аерозолів
- •4.4. Аерозолі в народному господарстві, природі та техніці
- •Захист навколишнього середовища від диму, пилу тощо
- •Порошки
- •5.1. Визначення порошків та їх розміри
- •5.2. Методи одержання порошків
- •5.3. Особливості порошків
- •5.4. Властивості порошків
- •Контрольні запитання
- •Тема 2.7. Розчинення високомолекулярних сполук план
- •1. Будова молекул високомолекулярних сполук
- •Конформації макромолекул високомолекулярних сполук
- •Природні і синтетичні високомолекулярні з’єднання
- •3. Набухання полімерів
- •Набухання в технології харчових виробництв
- •Загальна характеристика розчинів полімерів
- •Драглі, їх утворення
- •Тим, хто хоче знати більше характеристика нових синтетичних полімерів
- •Функції білків в організмі
- •Характеристика меду
- •Склад губної помади
- •Контрольні запитання
- •Література
2. Адсорбція на межі розчин – газ
Розчинені речовини в залежності від їх природи можуть концентруватися на поверхні розчину (адсорбуватися) або переходити в об'єм розчину. Це приводить до змін властивостей поверхні, наприклад поверхневого натягу.
Поверхнево-активними (ПАР) називають речовини, які зменшують поверхневий натяг розчинника.
Поверхнев–інактивними (поверхнево-неактивними) називають речовини, які збільшують поверхневий натяг або його не змінюють.
Ділення розчинених речовин на поверхнево-активні і поверхнево-неактивні умовне.
ПАР відносно води є багато органічних з'єднань - жирні кислоти, їх солі, спирти, карбонові кислоти та їх солі, естери аміни, кетони, білки, мила. Характерною особливістю будови молекул ПАР є їх дифільність. Дифільні (зазвичай органічні) молекули складаються з двох частин: полярної групи і неполярного вуглеводного радикала. Наприклад, молекула уксусної кислоти має полярну групу -СООН і неполярний вуглеводний радикал -СН3. До полярних груп, крім -СООН, відносяться групи: -ОН, -NН2, -SН, -CN , -HО2, -СНО, -SО2ОН. Ці групи добре гідратуються, тобто є гідрофільними. На відміну від них вуглеводневі радикали гідрофобні і сольватуються молекулами неполярних рідин.
Відносно води поверхнево-неактивними речовинами є всі неорганічні електроліти - солі, кислоти, луги. Прикладом органічних речовин, які практично не змінюють поверхневого натягу води є сахароза і лактоза.
Величина адсорбції Г на межі розчин-газ визначається не як кількість адсорбованої речовини на одиницю площі поверхні, а як надлишок речовини в поверхневому шарі, в порівнянні з кількістю речовини в такому ж по товщині шарі об'ємної фази. Між надлишком адсорбованої речовини в поверхневому шарі Г і концентрацією його в розчині С існує математична залежність, встановлена Гіббсом і відома як рівняння адсорбції Гіббса :
![]() ,
,
відношення dσ/dС називається поверхневою активністю.
Поверхнева активність dσ/dС – це міра здатності речовини знижувати поверхневу енергію на даній межі поділу.
Для ПАР (dσ/dС<0), тому Г>0, для поверхнево-неактивних речовин dσ/dС>0 і Г<0, тобто адсорбція від'ємна. Якщо поверхневий натяг не змінюється при зміні концентрації розчиненої речовини, то dσ/dС і Г=0. Поверхнева активність дифільних молекул ПАР залежить від розміру вуглеводневого радикалу.
Чим довший неполярний вуглеводневий ланцюг, тим більше молекул ПАР з об'єму розчину переходить поверхню і тим більше знижується поверхневий натяг.
Залежність між довжиною вуглеводневого ланцюга і здатністю ПАР знижувати поверхневий натяг сформульовано у вигляді правила Траубе:
Збільшення довжини ланцюга молекул ПАР в даному гомологічному ряду на одну групу –СH2 викликає збільшення поверхневої активності в 3-3,5 рази.
Молекули ПАР, які складаються з полярної групи і неполярного вуглеводневого радикала, на межі системи водневий розчин—газ утворюють адсорбційний шар товщиною в одну молекулу - молекулярний шар. Будова мономолекулярного шару, тобто розташування в ньому молекул, залежить від концентрації розчину. При низьких концентраціях ПАР в розчині і відповідно в адсорбційному шарі полярна група дифільної молекули занурена в воду, а її гнучкий вуглеводневий радикал лежить на поверхні води, бо між молекулами води і радикалом існують сили притягання. При збільшенні концентрації розчину молекули ПАР спочатку з'єднуються в агрегати, в яких вуглеводневі радикали орієнтуються паралельно один одного і перпендикулярно до поверхні води, а потім вся поверхня рідини покривається мономолекулярним шаром вертикально орієнтованих молекул. При подальшому збільшенні концентрації ПАР в розчині будова адсорбційного шару, а також поверхневий натяг не змінюється.
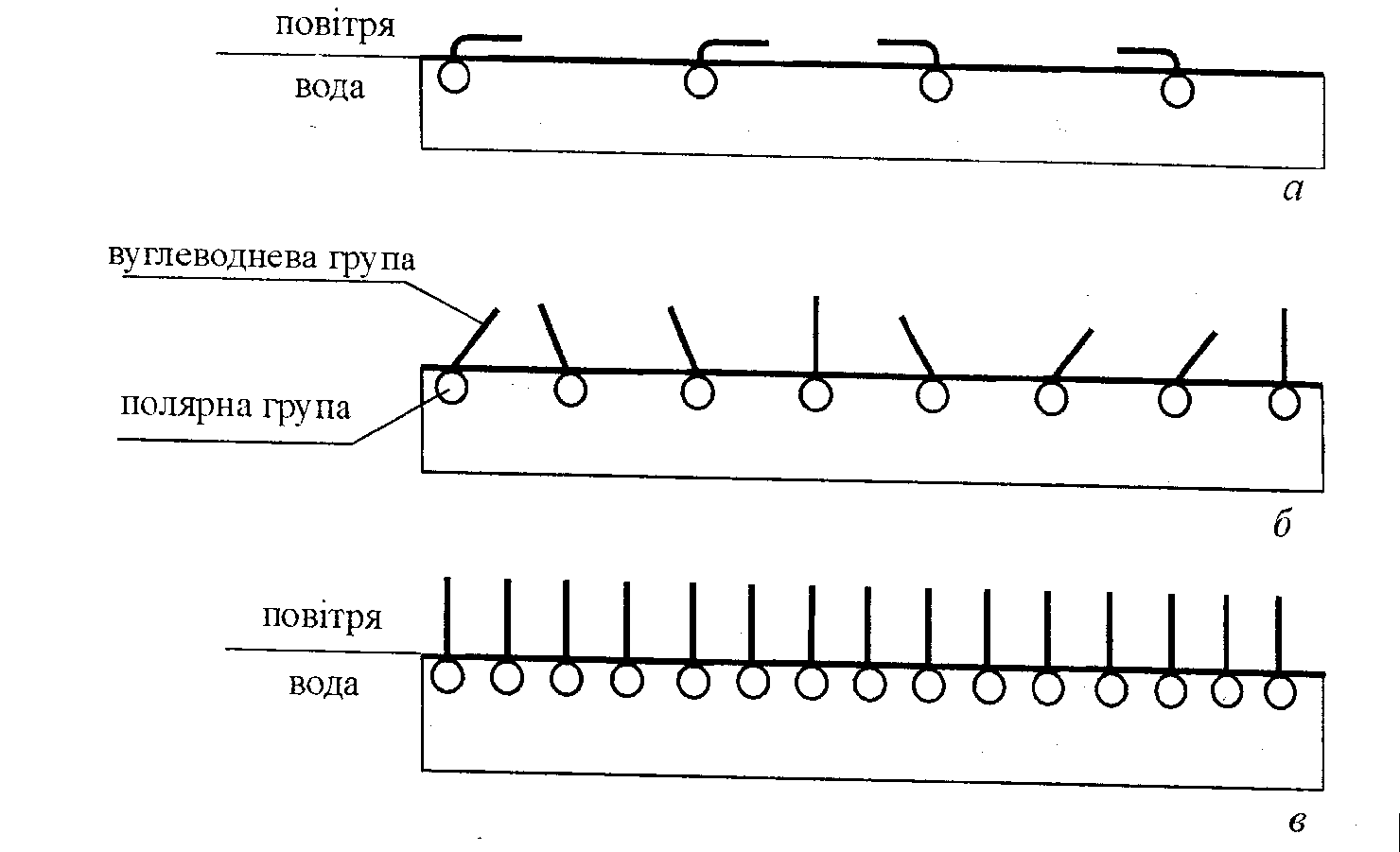
Рис.12. Розміщення молекул поверхнево-активної речовини на поверхні води при малих (а), середніх (б) і великих (в) концентраціях ПАР.
Знаючи величину адсорбції Г при утворені на поверхні мономолекулярного шару, можна розрахувати площу S0, яку займає одна молекула:
S0=1/(Г ∙ NА),
де NА – число Авогадро NА = 6,02∙1023моль-1,
(Г ∙ NА) - число молекул, адсорбованих на одиниці площі поверхні.
Площа S0, що займає одна молекула, не залежить від довжини вуглеводневого ланцюга і визначається тільки полярною групою дифільної молекули.
