
- •Лекция 11. Электрохимия
- •Ряд напряжений (стандартных электродных потенциалов).
- •Гальванические элементы
- •Пример:
- •Решение:
- •Электролиз
- •1. На аноде могут образовываться следующие продукты:
- •Электролиз раствора хлорида никеля NiCl2
- •Электролиз раствора йодида калия ki
- •Электролиз раствора сульфата калия
- •Электролиз раствора сульфата меди при медном аноде
- •Законы электролиза (м. Фарадей)
- •Лекция 12. Координационные соединения.
Гальванические элементы
Ч астично
металлы растворяются: ионы металлов
частично переходят в воду. Орицательные
заряды не дают катионам уйти далеко в
воду, следовательно, образуется двойной
электрический слой.
астично
металлы растворяются: ионы металлов
частично переходят в воду. Орицательные
заряды не дают катионам уйти далеко в
воду, следовательно, образуется двойной
электрический слой.
Любой металл погруженный в воду имеет в себе отрицательный заряд, величина этого заряда определяется свойствами металла.
Металлы в растворе собственной соли.

Количество ионов, которые будут взаимодействовать с раствором соли, будет меньше, т.к. соль уже содержит некоторое количество ионов этого металла.
Т.е. имеет большое значение какой металл и какая концентрация металла в соли, поведение металла.
Например: медь из раствора соли перейдет в электрод, т.е. имеются в виду положительные ионы.
Гальванический элемент – любое устройство, позволяющее получать электрический ток, за счет протекания химических реакций.
Гальваническая цепь – последовательная совокупность скачков потенциала на границе раздела фаз.
Максимальная разность потенциалов, отвечающая обратимому протеканию химической реакции – ЭДС (Е)
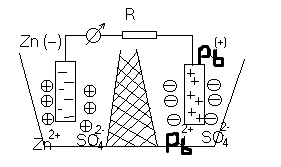
Каждые два металла, будучи погруженными в растворы их солей, которые сообщаются между собой посредством сифона, заполненного электролитом, образуют гальванический элемент. Пластинки металлов, погруженные в растворы, называются электродами элемента.
Если соединить наружные концы электродов (полюсы элемента) проволокой, то от металла, у которого величина потенциала меньше, начинают перемещаться электроны к металлу, у которого она больше (например, от Zn к Pb). Уход электронов нарушает равновесие, существующее между металлом и его ионами в растворе, и вызывает переход в раствор нового количества ионов – металл постепенно растворяется. В то же время электроны, переходящие к другому металлу, разряжают у его поверхности находящиеся в растворе ионы - металл выделяется из раствора.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом.
В свинцово-цинковом элементе цинковый электрод является анодом, а свинцовый – катодом.
Таким образом, в замкнутом гальваническом элементе происходит взаимодействие между металлом и раствором соли другого металла, не соприкасающимися непосредственно друг с другом. Атомы первого металла, отдавая электроны, превращаются в ионы, а ионы второго металла, присоединяя электроны, превращаются в атомы. Первый металл вытесняет второй из раствора его соли. Например, при работе гальванического элемента, составленного из цинка и свинца, погруженных соответственно в растворы Zn(NO3)2 и Pb(NO3)2 у электродов происходят следующие процессы:
Zn – 2ē ® Zn2+
Pb2+ + 2ē ® Pb
Суммируя оба процесса, получаем уравнение Zn + Pb2+ ↔ Pb + Zn2+, выражающее происходящую в элементе реакцию в ионной форме. Молекулярное уравнение той же реакции будет иметь вид:
Zn + Pb(NO3)2 ↔ Pb + Zn(NO3)2
Электродвижущая сила гальванического элемента равна разности потенциалов двух его электродов. При определении его всегда вычитают из большего потенциала меньший. Например, электродвижущая сила (Э.д.с.) рассмотренного элемента равна:
Э.д.с. = |
-0,13 |
– |
(-0,76) |
= 0,63 v |
|
EPb |
|
EZn |
|
Такую величину она будет иметь при условии, что металлы погружены в растворы, в которых концентрация ионов равна 1 г-ион/л. При других концентрациях растворов величины электродных потенциалов будут несколько иные. Их можно вычислить по формуле:
E = E0 + (0,058 / n) • lgC уравнение Нернста
или
E
= E0
+
![]() • lgC
• lgC
где E - искомый потенциал металла (в вольтах)
E0 - его нормальный потенциал
n - валентность металла (зарядность иона)
С - концентрация ионов в растворе (г-ион/л)
F – число Фарадея
R – универсальная газовая постоянная
Т – температура по абсолютной шкале
