1. Процессы
преобразования энергии в различных
тепловых машинах осуществляется с
помощью вещества, называемого рабочим
телом. В качестве рабочих тел могут
выступать вещества в жидком, газообразном
и твердом состояниях. Они являются
«посредниками» в процессе обмена
энергией между системой и окружающей
средой. Так, например, нагреваемый газ
расширяется и совершает механическую
работу. В результате происходит
преобразование тепловой энергии в
механическую. Рабочее тело характеризуют
различные параметры состояния –
давление, объем, температура, внутренняя
энергия, энтальпия, т.д.В качестве
основных параметров состояния принимают:
удельный объём, абсолютное давление
и абсолютную температуру. Удельным
объёмом называется объём единицы
массы вещества:
![]() м3/кг.
Масса единицы объёма, т.е. величина
обратная удельному объему, называется
плотностью:
м3/кг.
Масса единицы объёма, т.е. величина
обратная удельному объему, называется
плотностью:
![]() кг/м3
Абсолютным давлением называется
давление газа, обусловленное совокупностью
ударов беспорядочно движущихся молекул
о стенки сосуда, в котором заключен
газ, и представляет собой нормальную
силу F, действующую на единицу площади
А поверхности стенки:
кг/м3
Абсолютным давлением называется
давление газа, обусловленное совокупностью
ударов беспорядочно движущихся молекул
о стенки сосуда, в котором заключен
газ, и представляет собой нормальную
силу F, действующую на единицу площади
А поверхности стенки:
![]() кг/м2
= Па. Величина, характеризующая степень
нагретости тела, называется
температурой.Степень нагретости тел
связана со среднеквадратичной
скоростью движения молекул выражением:
кг/м2
= Па. Величина, характеризующая степень
нагретости тела, называется
температурой.Степень нагретости тел
связана со среднеквадратичной
скоростью движения молекул выражением:
![]() где
m = масса молекулы, k
– постоянная Больцмана, Т –
абсолютная температура.
где
m = масса молекулы, k
– постоянная Больцмана, Т –
абсолютная температура.
Абсолютная температура
измеряется в кельвинах (К) и всегда
положительна. Абсолютный нуль – это
температура, при которой прекращается
тепловое движение молекул, т.е. начало
отсчета температуры по шкале Кельвина.
Температура по шкале Кельвина связана
с температурой по шкале Цельсия
соотношением:![]()
2. (уравнение
сост идеаль газов)![]() где
где![]() — давление,
— давление,![]() — молярный
объём,
— молярный
объём,![]() — универсальная
газовая постоянная
— универсальная
газовая постоянная![]() — абсолютная
температура,К.
— абсолютная
температура,К.
3.(Дальтон) Закон о суммарном давлении смеси газов
Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
![]()
Закон о растворимости компонентов газовой смеси
При
постоянной температуре растворимость в
данной жидкости каждого из компонентов
газовой смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.![]()
4(масс
объем моль доли).
Массовая доля — отношение массы
растворённого вещества к массе раствора.
Массовая доля измеряется в долях единицы
или в процентах.![]() ,
,
где: m1 — масса растворённого вещества, г ; m — общая масса раствора, г .
Объёмная
доля — отношение объёма растворённого
вещества к объёму раствора. Объёмная
доля измеряется в долях единицы или в
процентах.![]() ,
,
где: V1 — объём растворённого вещества, л; V — общий объём раствора, л.
Мольная
(молярная) доля вещества — концентрация,
выраженная отношением числа молей вещества
к общему числу молей всех веществ,
имеющихся в растворе.![]()
Где
![]() —
мольная доля вещества B в растворе
—
мольная доля вещества B в растворе![]() — количество
вещества B,
содержащееся в растворе (измеряется
в молях)
— количество
вещества B,
содержащееся в растворе (измеряется
в молях)![]() —
сумма количества
вещества всех
компонентов раствора (измеряется
в молях)
—
сумма количества
вещества всех
компонентов раствора (измеряется
в молях)
5.(клайперона-менделеева)
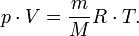 где где
— давление,
— молярный
объём,
— универсальная
газовая постоянная
— абсолютная
температура,К.
где где
— давление,
— молярный
объём,
— универсальная
газовая постоянная
— абсолютная
температура,К.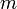 —
масса,
—
масса, 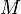 — молярная
масса,
уравнение состояния можно записать:
Эта форма записи носит имя уравнения
(закона) Менделеева — Клапейрона.
— молярная
масса,
уравнение состояния можно записать:
Эта форма записи носит имя уравнения
(закона) Менделеева — Клапейрона.
6(теплоемкость). Для вычисления количества теплоты, получаемой или отдаваемой системой при переходе из одного состояния в другое, используется понятие теплоемкости. Это одна из важнейших характеристик вещества. Различают молярную и удельную теплоемкости. Молярной теплоемкостью называют количество тепла, которое необходимо сообщить одному молю, вещества, чтобы повысить его температуру на 1К:
|
|
(4.4.1) |
Удельной теплоемкостью называют количество тепла, которое нужно передать 1 кг вещества, чтобы повысить его температуру на 1К:
|
|
|
В
последних формулах ![]() –
элементарное количество тепла, переданное
веществу,
–
элементарное количество тепла, переданное
веществу,![]() –
изменение его температуры, вызванное
этим теплом,
–
изменение его температуры, вызванное
этим теплом,![]() и
и ![]() –
число молей и масса вещества
соответственно.Из формул (4.4.1–4.4.2)
нетрудно получить связь между молярной
и удельной теплоемкостями:
–
число молей и масса вещества
соответственно.Из формул (4.4.1–4.4.2)
нетрудно получить связь между молярной
и удельной теплоемкостями:
|
|
|
где ![]() –
молярная масса. В дальнейшем, в основном,
будем использовать молярную теплоемкость,
которую будем называть просто
теплоемкостью.
–
молярная масса. В дальнейшем, в основном,
будем использовать молярную теплоемкость,
которую будем называть просто
теплоемкостью.
7(процессы). Пусть, для примера, происходит нагрев газа в сосуде, возможны два случая: если поршень зафиксирован и объем не меняется, то произойдет повышение давления в сосуде. Такой процесс называетсяизохорным (v=const), идущий при постоянном объеме.
|
Рисунок 1. Изохорные процессы в P – T координатах (v1>v2>v3). (обратно к содержанию) |
eсли поршень свободен то нагреваемый газ будет расширятся при постоянном давлении такой процесс называется изобарным (P=const), идущим при постоянном давлении.;
|
Рисунок 2. Изобарные процессы в v – T координатах P1>P2>P3 (обратно к содержанию) |
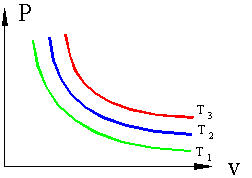
Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако можно охлаждая сосуд при сжатии газа и нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т=const).
|
Рисунок 3. Изотермические процессы в P – v координатах T1>T2>T3 (обратно к содержанию) |