
- •1. Какое положение занимают коллоидные системы в общей системе дисперсных систем?
- •2. Что такое степень дисперсности? Как классифицируются дисперсные системы по размеру частиц дисперсной фазы?
- •3. Как классифицируются дисперсные системы по агрегатному состоянию дисперсной фазы и дисперсной среды? Приведите примеры медико-биологического профиля.
- •4. Объясните. Почему коллоидно-дисперсные и грубодисперсные системы являются термодинамически неустойчивыми
- •5. Какие условия необходимо соблюдать для получения устойчивых эмульсий? Каково биологическое значение эмульсий?
- •6. Охарактеризуйте молекулярно-кинетические свойства золей и сравните их с истинными растворами
- •7. Объясните причину возникновения конуса Тиндаля при падении луча света на золь
- •8. Объясните, почему золи рассеивают преимущественно коротковолновое излучение
- •9. Какими способами можно отличить золь от грубодисперсной системы? На каких свойствах основаны эти способы?
- •10. Приведите примеры практического использования электрофореза. Какое значение имеет для характеристики коллоидно-дисперсных систем дзета-потенциал? Каким образом его можно определить
- •11. Что называют коагуляцией? Каковы внешние признаки коагуляции? Укажите возможные продукты коагуляции золей
- •12. Что такое электрофорез и электроосмос? Как объясняются эти явления?
- •13. Почему при электродиализе используется только постоянный электрический ток?
- •14. Каково строение мицелл лиофобных золей? Покажите это на примере мицеллы золя сульфида сурьмы (го)?
- •15. Какой коллоидный агрегат называется мицеллой? Что такое гранула?
- •16. Напишите формулу мицеллы сульфата бария, полученного сливанием одинакового объема сильно разбавленного раствора хлорида бария и менее разбавленного раствора серной кислоты
- •17. Напишите формулу мицеллы золя бромида серебра, полученного при взаимодействии разбавленного раствора нитрата серебра с избытком бромида натрия. Какой заряд будет иметь гранула?
- •18. Как можно получить гидрозоли сульфата кальция с различным знаком заряда коллоидных частиц? Напишите схемы строения мицеллы золя для каждого случая
- •19. Потенциалолределяющими ионами золя бромида серебра оказались ионы серебра. Напишите схему строения мицеллы этого золя
- •20. Дайте общую характеристику явления адсорбции. Почему адсорбция является наиболее эффективным регулятором поверхностных свойств дисперсных систем?
- •21. Объясните принцип классификации веществ на поверхностно-активные и поверхностно-инактивные
- •23. Укажите наиболее существенные особенности адсорбции пав на границе раздела двух жидкостей
- •24. Укажите наиболее существенные особенности адсорбции пав на поверхности твердых тел
- •25. По какому признаку вещества относят к высокомолекулярным соединениям?
- •27. Что такое набухание? Какие стадии в нем различают?
- •28. По каким признакам растворы высокомолекулярных соединений сходны с коллоидным растворами?
- •29. Чем отличается денатурация от коацервации?
- •31. Что называется суспензией? Какой вид устойчивости для нее характерен?
- •32. Что представляют собой эмульсии? Как их классифицируют?
- •33. Какие дисперсные системы называют пенами?
- •34. Что такое аэрозоли. Какими основными свойствами они обладают?
21. Объясните принцип классификации веществ на поверхностно-активные и поверхностно-инактивные
В
уравнении Гиббса влияние природы
вещества на адсорбцию отражается
производной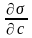 .
Эта производная определяет и знак
гиббсовской адсорбции, и может служить
характеристикой вещества при адсорбции.
Чтобы исключить влияние концентрации
на производную берут ее предельные
значения, т.е. при стремлении концентрации
к нулю. Эту величину Ребиндер назвал
поверхностной
активностью.
.
Эта производная определяет и знак
гиббсовской адсорбции, и может служить
характеристикой вещества при адсорбции.
Чтобы исключить влияние концентрации
на производную берут ее предельные
значения, т.е. при стремлении концентрации
к нулю. Эту величину Ребиндер назвал
поверхностной
активностью.
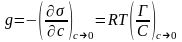 ;
;
g = [Дж×м/моль] = [Н×м2/моль]; [эрг см/моль] = [Гиббс].
Уравнение
показывает, что чем сильнее снижается
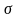 =
f(c)
с увеличением концентрации, тем больше
поверхностная активность этого вещества.
=
f(c)
с увеличением концентрации, тем больше
поверхностная активность этого вещества.
Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности и отнесенную к единице гиббсовской адсорбции.
Поверхностную активность можно представить как отрицательный тангенс угла наклона к касательной, проведенной к кривой Г = f(C) в точке пересечения с осью ординат. Поверхностная активность может быть положительной и отрицательной. Значение и знак ее зависят от природы растворенного вещества и растворителя.
1.
2<
1,
тогда
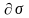 <0
и Г>0:
g>0
Þ
с увеличением концентрации поверхностное
натяжение на границе раздела фаз убывает
и вещество поверхностно-активно.
<0
и Г>0:
g>0
Þ
с увеличением концентрации поверхностное
натяжение на границе раздела фаз убывает
и вещество поверхностно-активно.
2< 1, то g<0: Г <0 Þ вещество поверхностно-инактивно.
g = 0, Г = 0 - адсорбции нет, т.е. вещество индифферентно.
Поверхностно-активными веществами являются органические вещества, состоящие из углеводородного радикала и функциональной группы. Неорганические соли являются поверхностно-инактивными веществами. Ребиндер и Щукин в своих работах показали, что развитие микротрещин в твердых телах при деформации может происходить гораздо легче при адсорбции веществ из среды, в которой ведется деформирование: адсорбироваться могут как ионы электролитов, так и молекулы поверхностно-активного вещества (ПАВ), образуя на адсорбирующей поверхности их двумерный газ в результате нелокализованной адсорбции. Молекулы под давлением этого газа проникают в устье трещин и стремятся раздвинуть их, таким образом содействуя внешним силам, т.е. наблюдается адсорбционное понижение твердости твердого тела, что получило название эффекта Ребиндера. Поверхностная активность в гомологическом ряду поверхностно-активных веществ (ПАВ) повышается в среднем в 3,2 раза на каждую группу СН2 (в водных растворах)– правило Дюкло – Траубе.
22. Напишите адсорбционное уравнение Гиббса для общего случая
Считаем Vповерхности раздела = 0.
dU
= TdS
+s
dS
+
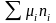
Проинтегрировав, получим:
U = TS + sS +
Полный дифференциал от этого уравнения:
dU
= TdS + SdT + sdS
+
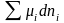 + Sds
+
+ Sds
+
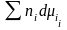 .
.
Подставляя значение dU из (6) в (7) и сократив одинаковые члены правой и левой части, получим:
SdT + Sds + = 0.
Предположим,
что T
= const:
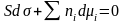
Разделив правую и левую часть на поверхность S, получим фундаментальное адсорбционное уравнение Гиббса:
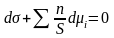 ;
; 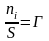 ;
;
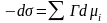 .
.
Определение зависимости поверхностного натяжения от адсорбции одного компонента, при постоянстве химических потенциалов других компонентов.
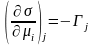 .
.
Известно,
что
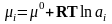 ,
,
 ,
(где
,
(где
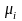 ,
,
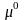 -
равновесный и стандартный химический
потенциал компонента i;
ln
ai-
логарифм активности i
–го компонента). Тогда уравнение Гиббса
будет выглядеть так
-
равновесный и стандартный химический
потенциал компонента i;
ln
ai-
логарифм активности i
–го компонента). Тогда уравнение Гиббса
будет выглядеть так
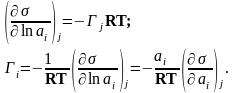
Активность связана с концентрацией: с = ×а. Предположим, что = 1 (при с ® 0). Тогда
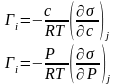 -
для жидкости и газа
-
для жидкости и газа

Обычно уравнение Гиббса применяют для растворов. Растворителем может быть не только индивидуальное вещество, но и смесь. В разбавленных растворах гиббсовская адсорбция очень мала, а его химический потенциал меняется очень мало с изменением концентрации растворенного вещества, т.е. dm= 0. Поэтому для разбавленного раствора фундаментальное уравнение Гиббса выглядит так:
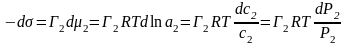
Из этих уравнений следует, что зная зависимость
= f(С)
(где С - концентрация растворенного вещества), можно рассчитать изотерму адсорбции, пользуясь адсорбционным уравнением Гиббса.
Схема графического расчета показана на рис. 2.2.2.1: Тангенс угла наклона соответствует значениям производных в этих точках.
Зная эти производные уравнения Гиббса, можно рассчитать значение Г, что позволяет построить зависимость Г = f(С). Уравнение Гиббса показывает, что единица измерения гиббсовской адсорбции не зависит от единицы измерений концентрации, а зависит от размерности величины R. Так как величина R отнесена к молю вещества, а s - к единице площади, то Г = [моль/ единица площади]. Если s выразить в [Дж/м2], то R нужно подставлять: R = 8,314 Дж/моль×К.
