
- •1. Основные положения мкт. Доказательство существования молекул. Размеры и масса молекул.
- •2. Строение газообразных, жидких и твердых тел
- •3. Опыт Штерна. Распределение молекул по скоростям
- •4. Идеальный газ. Изопроцессы.
- •Уравнение состояния идеального газа Менделеева - Клапейрона
- •5. Абсолютная температурная шкала. Абсолютный нуль температуры.
- •6. Основное уравнение молекулярно-кинетической теории идеального газа
- •7. Внутренняя энергия. Внутренняя энергия идеального газа
- •Количество теплоты
- •8. Первый закон термодинамики и его применение к различным процессам
- •1. Изобарный процесс. Работа газа.
- •2. Изохорный процесс. Теорема Майера
- •3. Изотермический процесс
- •4. Адиабатный процесс
- •9. Принцип действия тепловых двигателей. Кпд теплового двигателя
- •10. Испарение и конденсация. Насыщенные и ненасыщенные пары. Парообразование. Конденсация. Испарение.
- •11. Кипение. Удельная теплота парообразования.
- •12. Влажность воздуха
- •13. Кристаллические и аморфные тела. Свойства твердых тел
- •14. Сила упругости. Закон Гука. Виды деформаций
- •Диаграмма состояния вещества.
- •15. Необратимость тепловых процессов. Второй закон термодинамики и его статистический смысл
- •Механика
- •1. Аналитическое описание равноускоренного движения. Вывод формул для перемещения при равноускоренном движении
- •2. Относительность механического движения. Вывод формулы закона сложения скоростей. Относительная скорость
- •3. Движение тела, брошенного вертикально вверх, вертикально вниз. Вывод формулы для времени движения тела брошенного вертикально с высоты h.
- •4. Движение тела брошенного под углом к горизонту. Вывод формул дальности полета, максимальной высоты подъема, времени движения
- •5. Движение тела, брошенного горизонтально. Вывод формулы траектории движения, вывод формул для времени падения и дальности полета
- •6. Движение тела по окружности с постоянной по модулю скоростью. Угловая скорость, угол поворота, период обращения, частота. Связь между угловой и линейной скоростью.
- •7. Центростремительное ускорение (вывод формулы).
- •9. Закон сохранения импульса (вывод, границы применения)
- •10. Гидростатическое давление (вывод формулы). Сила Архимеда (вывод формулы). Условие плавания тел.
- •11. Механическая работа. Кинетическая энергия. Доказательство теоремы об изменении кинетической энергии
- •12. Работа силы тяжести и силы упругости, потенциальная энергия деформированной пружины (вывод формулы) и тела поднятого над Землей.
- •13. Условия равновесия тел. Момент силы
- •14. Силы сопротивления, сила трения покоя, сила трения скольжения
- •15. Закон сохранения механической энергии (границы применения), работа сил сопротивления.
4. Идеальный газ. Изопроцессы.
Состояние газа (так же как жидкости и твердого тела) может быть описано и без рассмотрения молекулярного строения вещества. Это делают с помощью макроскопических величин, совокупность которых однозначно определяет состояние системы. Такие величины называют параметрами состояния (или термодинамическими параметрами). Параметрами состояния любой системы являются ее объем, давление и температура. Если в каком-либо процессе изменяется хотя бы один из параметров состояния системы, то и само состояние системы становится другим.
Идеальным называют газ, при описании свойств которого делают два допущения: не учитывают собственный размер газовых молекул и не учитывают силы взаимодействия между молекулами. Таким образом, моделью идеального газа является совокупность хаотически движущихся материальных точек, взаимодействующих между собой и со стенками содержащего газ сосуда только при непосредственном столкновении.
Все газы при не слишком высоких давлениях и при не слишком низких температурах близки по своим свойствам к идеальному газу. При высоких давлениях молекулы газа настолько сближаются, что пренебрегать их собственными размерами нельзя. При понижении температуры кинетическая энергия молекул уменьшается и становится сравнимой с их потенциальной энергией, следовательно, при низких температурах пренебрегать потенциальной энергией нельзя.
Таким образом, при высоких давлениях и низких температурах газ не может считаться идеальным.
Изопроцессы идеального газа
Процессы, в которых один из параметров состояния газа не изменяется называются изопроцессами. Закономерности изопроцессов, происходящих с идеальным газом, были установлены экспериментальным путем, их называют эмпирическими законами идеального газа.
Изотермический процесс. Закон Бойля — Мариотта (m = const, Т = const)
П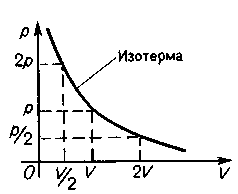 роцесс,
при котором давление и объем газа
меняются, а температура остается
постоянной, называют изотермическим.
(Чтобы осуществить изотермический
процесс, необходимо сжимать или расширять
газ очень медленно). Закон Бойля —
Мариотта: при неизменной массе газа
и постоянной температуре произведение
объема газа на его давление есть величина
постоянная.
роцесс,
при котором давление и объем газа
меняются, а температура остается
постоянной, называют изотермическим.
(Чтобы осуществить изотермический
процесс, необходимо сжимать или расширять
газ очень медленно). Закон Бойля —
Мариотта: при неизменной массе газа
и постоянной температуре произведение
объема газа на его давление есть величина
постоянная.
![]()
График закона Бойля — Мариотта (изотерма) в координатах р, V имеет вид гиперболы.
Так как плотность
= m/V, то
![]() - при неизменной массе газа и постоянной
температуре плотность газа пропорциональна
его давлению.
- при неизменной массе газа и постоянной
температуре плотность газа пропорциональна
его давлению.
Изобарный процесс. Закон Гей-Люссака (m = const, р = const).
Процесс, при котором давление газа постоянно, а температура и объем газа изменяются, называют изобарным. (Чтобы осуществить изобарный процесс, необходимо нагревать или охлаждать газ в цилиндре не закрепляя поршень.)
Обозначим V0 объем газа при 0°С, а V - его объем при t°C. При нагревании на t°C объем газа увеличивается на V = V – V0. Установлено, что относительное изменение объема газа при постоянном давлении пропорционально изменению его температуры, т. е. (V – V0)/ V0 = t, где - термический коэффициент объемного расширения газа (численно равен относительному изменению объема газа, происходящему при его нагревании на 1 °С). [] = К-1 (так как 1°С = 1 К).
Г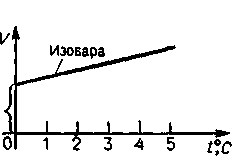 ей-Люссак
установил, что для всех идеальных газов
= 1/273.
ей-Люссак
установил, что для всех идеальных газов
= 1/273.
![]() - закон Гей-Люссака, описывающий изобарный
процесс: при неизменной массе газа и
постоянном давлении термический
коэффициент объемного расширения у
всех газов одинаков и равен 1/273.
- закон Гей-Люссака, описывающий изобарный
процесс: при неизменной массе газа и
постоянном давлении термический
коэффициент объемного расширения у
всех газов одинаков и равен 1/273.
График (изобара) представляет собой прямую, наклоненную к оси абсцисс и пересекающую ось ординат в точке, соответствующей объему газа при 0°С.
Изохорный процесс. Закон Шарля (m = const, V = const).
Процесс, при котором объем газа постоянен, а температура и давление газа изменяются, называют изохорным. (Чтобы осуществить изохорный процесс, необходимо нагревать или охлаждать газ в закрытом сосуде).
Обозначим р0 давление газа при 0°С, а р - его давление при t°C. При нагревании газа на t°C его давление увеличивается на р = р - ро. Установлено, что относительное изменение давления газа пи постоянном объеме пропорционально изменению температуры газа, т. е. (р – р0)/р0 = t, где - температурный коэффициент давления газа (равен относительному изменению давления газа, происходящему при его нагревании на 1 °С). [] = К-1.
Ш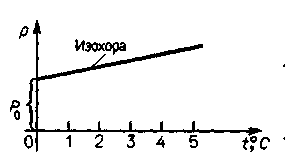 арль
установил, что для всех идеальных газов
= 1/273.
арль
установил, что для всех идеальных газов
= 1/273.
![]() -
закон Шарля, описывающий изохорный
процесс: при неизменной массе газа и
постоянном объеме температурный
коэффициент давления у всех газов
одинаков и равен 1/273.
-
закон Шарля, описывающий изохорный
процесс: при неизменной массе газа и
постоянном объеме температурный
коэффициент давления у всех газов
одинаков и равен 1/273.
График закона Шарля (изохора) представляет собой прямую, наклоненную к оси абсцисс и пересекающую ось ординат в точке, соответствующей делению газа при 0°С.
