
Билет №9
Большинство хим реакция обратимо те протекает одновременно в противоположных направлениях. В состоянии хим равновесия скорость прямой реакции равна скорости обратной реакции. О степени глубины протекания процесса можно судить на основании закона действующих масс. которому подчиняется система в состоянии равновесия: частное от деления произведения равновесных концентраций продуктов реакции на произведение равновесных концентраций исходных веществ является величиной постоянной, константа равновесия.
Kc=[D]^d[E]^e/[A]^a[B]^b
Для газообразных веществ используются равновесные парциальные давления реагентов.
По значению конастанты можно судить о направлении процесса при исходном соотношении концентрация реагирующих веществ, а максимально возможном выходе продукта.
Константа зависит от природы реагентов и от температуры. Она связана с изменением стандартной энергии Гиббса хим реакции ∆G=-RT ln K ∆G298=-5,71 lg K298
∆G<< 0 => K>>1 в смеси преобладают продукты реакции
∆G>>0 => K<<1 в смеси преобладают исходные вещества
N2+3H2=2NH3
Н2СО3 = Н+ + НСО3-
RA-H.....:BR1
С одним из атомов водород связан значительно сильнее (за счет ковалентной связи), чем с другим. Последняя связь называется водородной. Водородная связь сильнее вандерваальсово взаимодействие, но слабее ковалентной. Она характерна для соединений водорода с наиболее электроотрицательными элементами: фтор, кислород, азот.
В
твердом, житком, газовом состояниях
молекулы фторида водорода ассоциированы
в зигзагообразные цепочки вида что
обусловлено водородной связью: 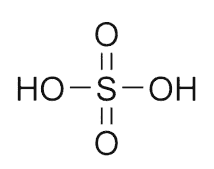
 с107
с107
Температура плавления в ряду не однородна. Самая высокая у воды, потом H2Te, H2Se,H2S
H2SO3S - тиосерная кислота (как серная)
H2SO4 - серная кислота
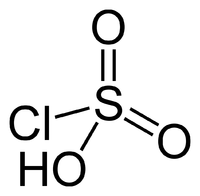
HSO3Cl - Хлорсульфо́новая кислота
H2SO3(O2) - кислота каро
Благодаря наличию серы в со −2 тиосульфат-ион обладает восстановительными свойствами. Слабыми окислителями (I2, Fe3+) тиосульфаты окисляются:
2S2O32− + 2Fe3+ → S4O62− + 2Fe2+
Более сильные окислители окисляют тиосульфаты до сульфатов:
S2O32− + 4Cl2 + 5H2O → SO42− + 8Cl− + 10H+
Сильные восстановители восстанавливают тиосульфат-ион до сульфида, например:
3S2O32− + 8Al + 14OH− + 9H2O → 6S2− + 8[Al(OH)4]−
пероксид водорода обладает свойствами как окислителя
KNO2+H2O2=KNO3+H2O
2KI+H2O2=I2+2KOH
так и восстановителя:
Ag2O+H2O2=2Ag+H2O+O2
Билет №10.
1. Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол.
Насыщаемость КС – это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.
Валентный угол — угол, образованный направлениями химических связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома.
угол между хлорами в Cl2O 110,9
В природе нет чистой воды. Ее получают в процессе перегонки. Чистая вода - жидкость без вкуса и запаха, прозрачна. По массе в состав воды входит 88,81% кислорода и 11,19% водорода, вода кипит при температуре +100°С, а замерзает при 0°С, она плохой проводник для электричества и теплоты, но хороший растворитель, она обладает высокой теплоемкостью.
Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Ее амфотерные свойства обусловлены способностью воды к самоионизации:
2Н2О(ж.) = Н3О+(водн.) + ОН-(водн.)
Это позволяет воде быть, с одной стороны, акцептором протона:
НСl + Н2О = Н3О+ + Сl
а с другой стороны-донором протона:
NH3 + Н2О = NH4 + ОН-
Ионное произведение воды, произведение концентраций (точнее активностей) ионов водорода Н+ и ионов гидроксила OH— в воде или в водных растворах. При 25 °C константа диссоциации воды равна 1,8×10−16моль/л.
Она реагирует с кислотными и некоторыми основными оксидами:
CaO + H2O = Ca(OH)2
с активными металлами:
2Na + 2H2O = 2NaOH + H2↑
окислительные свойства воды наиболее сильно проявляются в кислой среде, а восстановительные — в щелочной.
Вода – окислитель за счет H+:
H2O (перегретый пар) + C (кокс) ↔ CO + H2
2H2O + CaH2 = Ca(OH)2 + 2H2↑
Вода – восстановитель за счет O–2:
4KMnO4 + 2H2O = MnO2↓ + 3O2↑ + 4KOH (t°)
Важен электролиз воды:
2H2O = 2H2↑ + O2↑ (электролиз)
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O.
Билет №11
Скоростью реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема для гомогенных реакций или на единице по
 верхности
раздела фаз для гетерогенных реакций.
Скорость реакций характеризуют
изменнением концентрации какого-либо
из исходных или конечных продуктов
реакции в единицу времени.
верхности
раздела фаз для гетерогенных реакций.
Скорость реакций характеризуют
изменнением концентрации какого-либо
из исходных или конечных продуктов
реакции в единицу времени.
A+B=C+D например для этой реакции выражение скорости: V= d[C]/dt = - d[A]/dt
Кроме концетрации на скорость хим.реакции влияет: 1)природа реаг.вещ-в 2) катализатор 3) температура (правило Вант-Гоффа) 4) давление 5) площадь поверхности реаг.вещ-в
Энергия активации — это некоторое избыточное количество энергии (по сравнению со средней), необходимое для вступления молекул в реакцию. Чем больше активных молекул, тем скорость реакции выше.
Согласно Аррениусу, константа скорости химической реакции зависит от температуры экспоненциально:
![]()
Здесь Е — энергия активации (Дж/моль), R — универсальная газовая постоянная, T — температура в К,
А — константа.
2.С
точки зрения теории молекулярных
орбиталей, строение двухатомной молекулы
фтора можно охарактеризовать следующей
диаграммой. В молекуле присутствует 4
связывающих орбитали и 3 разрыхляющих.
Порядок связи в молекуле равен 1.У фтора
валентность=1.
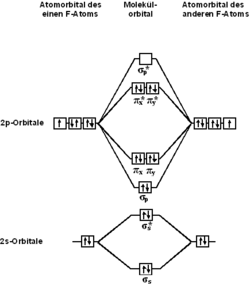 У
остальных галогенов будет такой же
рисунок только электронов будет больше
и валентность и порядок связи тоже будет
больше.
У
остальных галогенов будет такой же
рисунок только электронов будет больше
и валентность и порядок связи тоже будет
больше.
На соседнем с внешним уровне у фтора два электрона, у
хлора – восемь и у брома, йода и астата – восемнадцать электро-
нов. Последние три элемента – полные электронные аналоги. . Галогены – наиболее типичные не-
металлы, причем фтор обладает наибольшим значением элек-
троотрицательности. В ряду F → Cl → Br → I → At увеличива-
ются радиусы атомов, уменьшается электроотрицательность
элементов, ослабевают неметаллические свойства и окислитель-
ная способность галогенов.
Стандартный
электродный потенциал
F= +2,87 CL=+1,36 Br = +1,07 I = +0,54
3.. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
С(графит)+H20(г)=H2(г)+CO(г)
G298 = сумма(продуктов реакции)- сумма(исх.вещ-в)= (0+380,16)-(669,7-228,4)= -62,94 кдж\моль
НЕДОДЕЛАНО.
БИЛЕТ № 12
1. Энтальпия (Н) - количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении.Тепловой эффект при постоянном давлении обозначается ΔН и называют изменением энтальпии. 𝑸=−ΔH Экзотермический эффект считается отрицательным (энтальпия системы уменьшается). Эндотермический эффект считается положительным (энтальпия системы возрастает).Уравнения, в которых указан тепловой эффект, называются термохимическими.Величина ΔН относится к числам молей веществ, равным коэффициентам при их формулах. В термохимических уравнениях обязательно указывают агрегатное состояние вещества: Рассчитать теплоты образования нестабильных соединений и тепловые эффекты реакций, которые нельзя осуществить экспериментально позволяет закон Гесса
2KClO3(к)=2KCl(к)+3O2(г)
∆H 298 = ∑(прод. Реак-и)-∑(исх.вещ-в)= (2*(-435,9)+3*0)-2*(-391,2)=-871,8+782,4=-89,4
∆H<0 значит реакция экзотермическая. Реакция является необратимой т.к H<0 и S>0
2. СЕРА.Существует несколько известных аллотропных модификаций серы:
1) циклическая форма;
2) моноклинная форма;
3) кристаллическая ромбическая форма.
Сера – неметалл с типичными для него свойствами. Взаимодействует со многими металлами непосредственно (медью, железом, цинком), выделяя при этом теплоту. Среди металлов лишь золото, платина и рутений не вступают в реакцию с серой. Взаимодействует также с большинством неметаллов, за исключением азота и йода.
Химические свойства:
1) при нагревании сера реагирует с водородом, образуя сероводород: S + Н2 = H2S;
2) взаимодействуя с металлами, сера образует сульфиды: S + Fe = FeS; 2Al + 3S = Al2S3;
3) при сжигании серы в струе кислорода образуется сернистый газ или сернистый ангидрид SO2: S + O2 = SO2;
4) чистая сера способна проявлять восстановительные свойства: S + 2HNO3 = H2SO4 + 2NO.
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании:
S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц.) = 3SO2 ↑ + 2H2O
3. В ряду хим связь изменяются от ионной до ковалентной. Ионные хлориды - твердые кристиллические вещества с аысокой температурой плавления, ковалентные - газы или жидкости. Промежуточное положение занимают ионно-ковалентные хлориды.
NaCl MgCl2 AlCl3 SiCl4 PCl5
Основные Амфотерные Кислотные
Основные хлориды гидролизу не подвергаются, а кислотные гидролизуются полностью и необратимо с образованием кислот:
SiCl4+3HOH=H2SiO3+4HCl
Основные хлориды (за счет хлорид-ионов) являются донорами электронных пар, а кислотные-акцепторами. Амфотерные хлориды взаимодействуют как с кислотными, так и с основными соединениями.
KCl+AlCl3=K[AlCl4]
Все хлориды 3 периода растворимы в воде. Хлориды получают хлорированием простых веществ хлором или сухим хлоридом водорода.
2Na+Cl2=2NaCl
2Na+2HCl=2NaCl+H2
А так же взаимодействием оксидов с хлором (или хлоридами) в присутствии угля:
SiO2+2Cl2+C=SiCl4+CO2
Основные хлориды гидролизу не подлежат.
Al3+ + НОН =AlOH2+ + Н+,
Al3+ + 3Cl– + H2O =AlОH2+ + 2Cl– + H+ + Cl–,
AlCl3 + H2O =AlOHCl2 + HCl
БИЛЕТ №13
1. В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f-элементы. Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются s-элементами. У s-элементов валентными являются s-электроны внешнего энергетического уровня. У р-элементов последним заполняется р-подуровень внешнего уровня. У них валентные электроны расположены на p- и s-подуровнях внешнего уровня. У d-элементов в последнюю очередь заполняется d-подуровень предвнешнего уровня и валентными являются s-электроны внешнего и d-электроны предвнешнего энергетического уровней. У f-элементов последним заполняется f-подуровень третьего снаружи энергетического уровня.
Пример
Водород; атомный номер = 1; число электронов = 1
Этот единственный в атоме водорода электрон должен занимать s-орбиталь, поскольку из всех возможных орбиталей она имеет самую низкую энергию.Электрон на этой s-орбитали называется ls-электрон. Водород в основном состоянии имеет электронную конфигурацию 1s а сверху 1
2. СО хлора в этих соединениях увеличивается +1, +3, +5, +7
ClO ClO2 ClO3 ClO4 -> ослабевают окислительные свойства, устойчивость возрастает (за счет дополнительных пи связей), возрастает сила кислот
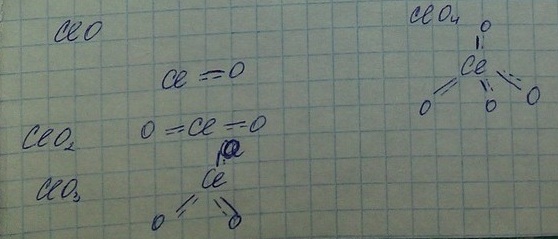
ClO+2H2O+2e=Cl- + 2OH- E= 0,88
ClO3+3H2O+6e=Cl+6OH E=0,63
ClO4+4H2O+8e=Cl- +8OH E=0,56
3. 2NaCl(к)+H2SO4(ж)=Na2SO4(к)+2HCl (г)
∆H298=∑(продук)-∑(исходных)=(-1384,6+2*(-91,8))-(2*(-411,1)-814,2)=68,4
∆H>0, значит реакция эндотермическая и ∆S>0 то следует что реакция необратимая.
БИЛЕТ № 14
1. Введение гибридных орбиталей служит для описания направленных локализованных связей. Число
Гибридных орбиталей равно числу АО участвующих в гибрид-ии.Гибр-ся близкие по энергии валентные АО независимо от того заполнены они или пусты

2. Наиболее распространенным во Вселенной элементом является водород. Атом водорода состоит из одного положительного заряда - протона, который находится в ядре, и одного отрицательного - электрона, который располагается на орбите. В ядре атома водорода может также находиться несколько нейтральных частиц – нейтронов. Водород имеет три изотопа: протий 1H, дейтерий 2Н (или D) и тритий 3Н
Физ.св-ва: Водород — самый лёгкий газ без цвета, запаха и вкуса при н.у, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха. Температура кипения −252,76 °C, удельная теплота сгорания 120.9×106 Дж/кг, малорастворим в воде — 18,8 мл/л. Существует также жидкий водород и твердый.
Хим.св-ва: Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Получение в пром-сти: 1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
H2O + C ⇄ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇄ CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇄ 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
ПОЛУЧЕНИЕ В ЛАБ-ИИ: 1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
2.Взаимодействие кальция с водой:Ca + 2H2O → Ca(OH)2 + H2↑
3.Гидролиз гидридов
NaH + H2O → NaOH + H2↑
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e− → H2↑ + 2H2O
3. значит направление Cr2O7 (2-) +14H + 6e= 2Cr (3-) + 7H2O E=1,333 В
Fe (3+) +e=Fe (2+) E=0, 771
K2Cr2O7+6FeSO4+7H2SO4=K2SO4+Cr2(SO4)3+ 3Fe2(SO4)3+7H2O
БИЛЕТ №15
1. Константа Равновесия - отношение между концентрациями продуктов реакции и исходных веществ, которое характеризует ХИМИЧЕСКОЕ РАВНОВЕСИЕ ОБРАТИМОЙ РЕАКЦИИ при определенной температуре.
HClO3=H+ + ClO3-
K (ионизации)= [H+]*[ClO3-]/ [HClO3] ≈ 10 в третьей степени.
К(иониз. HClO4)= 10 в восьмой степени, т.е K(ион HClO4)>K(ион HClO3) , а как мы помним, чем меньше константа ионизации, тем слабее кислота.
2. Метод валентных связей (МВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F2+ и O2+, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N2+, чем а молекуле N2; существование молекулярного иона He2+ и неустойчивость молекулы Нe2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи – метод молекулярных орбита-лей (МО). В отличие от ММО, в котором простейшая химическая связь может быть как двух-, так и многоцентровой, в МВС она всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Так же, как и в ММО, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
Отметим, что электроны, описываемые ЛО, в соответствии с принципом Паули должны иметь противоположно направленные спины, то есть в МВС все спины спарены, и все молекулы должны быть диамагнитны. Следовательно, МВС принципиально не может объяснить магнитные свойства молекул.
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также кислород при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например: Н2О2 + 2KI + H2SO4 = I2 + K2SO4 + 2H2O
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
O22− — 2e− → O2
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
3. Энтальпия (Н) - количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении.Тепловой эффект при постоянном давлении обозначается ΔН и называют изменением энтальпии. 𝑸=−ΔH Экзотермический эффект считается отрицательным (энтальпия системы уменьшается). Эндотермический эффект считается положительным (энтальпия системы возрастает).Уравнения, в которых указан тепловой эффект, называются термохимическими.Величина ΔН относится к числам молей веществ, равным коэффициентам при их формулах. В термохимических уравнениях обязательно указывают агрегатное состояние вещества: Рассчитать теплоты образования нестабильных соединений и тепловые эффекты реакций, которые нельзя осуществить экспериментально позволяет закон Гесса.
H2(г)+I2(г)=2HI(г) -53,14 кдж
∆H298=∑(продук.реак-и)-∑(исх.вещ-в)= (2*26,57 )-(0+ 62,43)= -9,29 кдж/моль
∆H<0 , значит реакция экзотермическая, следовательно ∆S>0, а это значит что реакция необратимая
