
- •«Уральский государственный университет путей сообщения»
- •Специальность: 190901.65
- •1.Строение и свойства атомов водорода
- •1.1.Образование атома водорода и его спектр излучения
- •1.2.Возбуждение и ионизация атома водорода
- •1.3.Строение атома водорода в основном состоянии
- •1.4.Атом водорода в электрическом поле
- •1.5.Взаимодействие атома водорода с протоном
- •Взаимодействие атома водорода с электроном
- •1.6.Рекомбинация атомов водорода
- •2.Атом водорода в квантовой механике
- •2.1.Энергия.
- •2.2.Квантовые числа.
- •2.3.Спектр.
- •3.Линейчатый спектр атома водорода
- •4.Спектр атома водорода по Бору
- •4.1.Нахождение энергии электрона из модели Бора
- •6.Математическое описание атома водорода
- •6.1.Энергетический спектр
- •6.2.Волновые функции
- •6.3.Угловой момент
- •7.Визуализация орбиталей атома водорода
- •1.Трофимова т.И. Курс физики. 11-е изд., стер. - м.: Академия, 2006.— 560 с
Взаимодействие атома водорода с электроном
Основная статья: Гидрид-ион
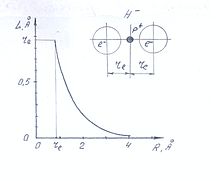
Рис. Деформационная поляризация атома водорода под действием приближающегося электрона и модель гидрид-иона H-
Электрон, обладая элементарным электрическим зарядом, как и протон создаёт вокруг себя электрическое поле, но в отличие от электрического поля протона с отрицательным знаком. Нейтральный атом водорода, попадая в электрическое поле электрона подвергается деформационной поляризации. Центр электронной оболочки атома водорода смещается относительно ядра на некоторое расстояние L в противоположную сторону к приближающемуся электрону. Приближающийся электрон как бы вытесняет из атома водорода находящийся в нём электрон, подготавливая место для второго электрона. Величина смещения центра электронной оболочки атома водорода L обратно пропорциональна квадрату расстояния атома водорода к приближающемуся электрону R:
L = αe/R2 = 0.66/R2 (рис)
Сближение атома водорода и электрона возможно до тех пор, пока центры областей плотностей вероятности нахождения обоих электронов не станут равноудалёнными от ядра объединённой системы — отрицательно заряженного иона водорода. Такое состояние системы имеет место при:
re = L = R = 3√0,66 = 0,871 Å.
Где re — орбитальный радиус двухэлектронной оболочки гидрид-иона H-.
Таким образом, атом водорода проявляет своеобразную амфотерность, он может взаимодействовать как с положительно заряженной частицей (протоном), образуя молекулярный ион водорода H2+, так и с отрицательно заряженной частицей (электроном), образуя гидрид-ион H-.
1.6.Рекомбинация атомов водорода
Рекомбинация атомов водорода обсуловлена силами межатомного взаимодействия. Происхождение сил, вызывающих притяжение электрически нейтральных атомов друг к другу, было объяснено в 1930 году Ф.Лондоном. Межатомное притяжение возникает вследствиефлуктуации электрических зарядов в двух атомах, находящихся близко друг от друга. Поскольку электроны в атомах движутся, то каждый атом обладает мгновенным электрическим дипольным моментом, отличным от нуля. Мгновенный диполь (электродинамика) на одном атоме наводит противоположно направленный диполь в соседнем атоме. Наступает синхронизация колебаний двух атомов – двух осцилляторов, частоты которых совпадают. Результатом этого процесса является образование молекулы водорода.
Наличие мгновенного электрического дипольного момента у атома водорода выражается в характерной особенности атома водорода, проявляющейся в крайней реакционной способности атомарного водорода и склонности его к рекомбинации. Время существования атомного водорода составляет около 1 сек. Под давлением в 0.2 мм рт. ст. Рекомбинация атомов водорода имеет место, если образующаяся молекула водорода быстро освобождается от избытка энергии, выделяющейся при взаимодействии атомов водорода путём тройного столкновения. Соединение атомов водорода в молекулу протекает значительно быстрее на поверхности различных металлов, чем в самом газе. При этом металл воспринимает ту энергию, которая выделяется при образовании молекул водорода, и нагревается до очень высоких температур. Тепловой эффект реакции образования молекулярного водорода из атомов водорода составляет 103 ккал/моль.
На принципе рекомбинации атомов водорода разработана атомно-водородная сварка. Между двумя вольфрамовыми стержнями создаётся электрическая дуга, через которую по облегчающим стержни трубкам пропускается ток водорода. При этом часть молекул водорода распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещаемой на небольшом расстоянии от дуги. Металл может быть таким путём нагрет до температуры выше 3500° C [7].
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения водорода в атомарное состояние (α) в зависимости от абсолютной температуры (T) представлены в таблице[8]:
-
T, к
2000
3000
4000
5000
6000
8000
Кр
2,62 · 10-6
2,47 · 10-2
2,52
4,09 · 10
2,62 · 102
2,70 · 103
α
8,10 · 10-4
7,83 · 10-2
0,621
0,954
0,992
0,999
