
- •1.Техническая термодинамика. Определение. Общие сведения.
- •2.Термодинамическая система. Определение.
- •3.Термодинамический процесс. Работа процесса. I – закон термодинамики.
- •4.Диаграммы термодинамических процессов в pv, ts и hS координатах.
- •5.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
- •6.Термодинамические процессы изменения состояния газа.
- •Изохорные процессы в p - t координатах:
- •Изобарные процессы в V - t координатах
- •Изотермические процессы в p-V координатах
- •7. Смеси идеальных газов.
- •8.Теплоемкость газов.
- •9.Истечение газов.
- •10.Теплообмен. Виды теплообмена.
- •Виды теплообмена:
- •11. Теплопроводность. Основы теории.
- •12. Конвективный теплообмен.
- •13.Факторы влияющие на интенсивность теплообмена.
- •14.Лучистый теплообмен.
- •15.Круговой процесс. Цикл Карно.
- •Цикл Карно и максимальный кпд тепловой машины
- •16.Параметры состояния термодинамической системы (давление, температура, удельный объем).
- •17.Энтальпия. Энтропия. Определение. Физический смысл. Размерность.
- •18.Политропный процесс. Частные случаи политропного процесса.
- •В зависимости от процесса можно определить значение n:
- •20. Уравнение состояния реальных газов.
- •21.Параметры и функции состояния воды и водяного пара.
- •22. Процесс парообразования в pv-координатах.
- •23.Второй закон термодинамики
- •24. Принцип работы турбины.
- •25. Паротурбинные установки. Циклы пту.
- •Циклы паротурбинных установок (пту)
- •26. Газотурбинные установки. Циклы газотурбинных установок (гту)
- •27.Методе повышения экономичности работы паротурбинных и газотурбинных установок.
- •28.Промышленные холодильные установки. Циклы холодильных установок.
- •Циклы холодильных установок
- •29. Теплопередача. Общий вид уравнения.
- •Основное уравнение теплоотдачи
- •30.Цикл Ренкина.
- •Кпд цикла
- •Обратный цикл Ренкина
- •31.Цикл двигателей внутреннего сгорания.
- •Типы двс
- •Газотурбинный двс
- •Двс классифицируют:
- •Циклы работы поршневых двс
- •32.Паросиловые установки. Перегрев пара. Термический кпд. Удельный расход пара.
- •Перегретый пар
- •33.Котельные установки. Типы котлов и конструктивные особенности.
- •34.Котельно-вспомогательное оборудование. Назначение и основные характеристики.
- •35.Тепловой баланс котлоагрегата.
- •36.Конструктивные особенности паровых и водонагревательных котлов.
- •37.Водоподготовка и водный режим паровых водогрейных котлов. Водоподготовка
- •Новыми высокотехнологичными элементами систем водоподготовки являются:
- •38.Топливо. Виды топлив. Общая характеристика.
- •Основные современные виды топлива
- •Жидкие топлива
- •Газообразные топлива
- •Дисперсные системы, растворы
- •Нетипичные топлива
- •39.Процессы горения. Расчет процесса горения.
- •Статическая сирена для процессов горения
- •40.Топки котлов и печей. Классификация и характеристика топочных устройств.
- •Классификация и конструктивные особенности топочных устройств
- •41.Особенности сжигания твердых и газообразных топлив. Особенности горения твердого топлива
- •Особенности сжигания газообразного топлива
- •42.Тепловые электрические станции. Общин сведения.
- •43.Тепловые сети.
- •44.Основные элементы тепловых сетей.
- •45. Расчет тепловых сетей
- •46.Системы теплоснабжения (водяные теплосети).
- •47.Системы пароснабжения. Сбор и возврат конденсата.
- •Сбор и возврат конденсата.
- •Возможные проблемы:
- •48.Режимы работы систем теплоснабжения.
- •49.Температурные графики систем отопления и горячего водоснабжения. Температурный график отопления
- •50.Наладка и регулирования систем теплоснабжения. Наладка систем теплоснабжения
- •Регулирование системы отопления
- •51.Теплообменные аппараты. Основные типы. Конструкция.
- •Основные типы
- •Конструкции теплообменников
- •52.Расчет теплообменных аппаратов.
- •Уравнение теплопередачи:
- •Величину произведения
- •Для аппаратов с прямотоком
- •Для аппаратов с противотоком
- •53.Сушильные установки.
- •54.Промышленные печи.
1.Техническая термодинамика. Определение. Общие сведения.
Термодинамика — раздел физики, изучающий соотношения и превращения теплоты и других форм энергии.
2.Термодинамическая система. Определение.
Термодинамической системой - называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой.
Температура тел - определяет направление возможного самопроизвольного перехода тепла между телами.
T [K] = t [º C] + 273.15
Давление - представляет собой силу, действующею по нормали к поверхности тела и отнесенную к единице площади этой поверхности.
1 бар = 105 Па
1
кг/см2
(атмосфера) = 9.8067![]() 104
Па
104
Па
1мм рт. ст (миллиметр ртутного столба) = 133 Па
1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па
Плотность - отношение массы вещества к объему занимаемому эти веществом.
![]()
Удельный объем - величина обратная плотности т.е. отношения объема занятого веществом к его массе.
![]()
3.Термодинамический процесс. Работа процесса. I – закон термодинамики.
Термодинамический процесс - если в термодинамической системе меняется хотя бы один из параметров любого входящего в систему тела.
Основные термодинамические параметры состояния Р, V, Т однородного тела зависят один от другого и взаимно связаны уравнением состояния:
F (P, V, Т)
Для идеального газа уравнение состояния записывается в виде:
![]()
Р = f1 (v, т); v = f2 (Р, Т); Т = f3 (v, Р)
Работой процесса - передача энергии в термодинамическом процессе от одного тела к другому, связанная с изменением объема рабочего тела, с перемещением его во внешнем пространстве или с изменением его положения.
1-й закон термодинамики — первое начало термодинамики. Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как δQ = δA + dU, где dU есть полный дифференциал внутренней энергии системы, а δQ и δA есть элементарное количество теплоты, переданное системе, и элементарная работа, совершенная системой соответственно. Нужно учитывать, что δA и δQ нельзя считать дифференциалами в обычном смысле этого понятия, поскольку эти величины существенно зависят от типа процесса, в результате которого состояние системы изменилось.
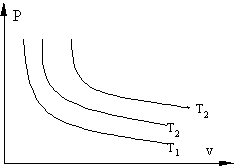
4.Диаграммы термодинамических процессов в pv, ts и hS координатах.
Изотермические процессы в P-v координатах
Т1>T2 >T3
Процесс, при котором отсутствует теплообмен между системой и окружающей средой, называется адиабатным, при этом количество теплоты в системе остается постоянными (Q=const). В реальной жизни адиабатных процессов не существует поскольку полностью изолировать систему от окружающей среды не возможно. Однако часто происходят процессы, при которых теплообменном с окружающей средой очень мал, например, быстрое сжатие газа в сосуде поршнем, когда тепло не успевает отводиться за счет нагрева поршня и сосуда.
5.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
![]()
R - газовая постоянная (у каждого газа свое значение)
Если известно уравнение состояния, то для определения состояния простейших систем достаточно знать две независимые переменные из 3-х
Р = f1 (v, т); v = f2 (Р, Т); Т = f3 (v, Р)
