
- •Н. А. Колпакова, с. В. Романенко, в. А. Колпаков Физическая химия Часть ιι
- •Глава 1. Термодинамика растворов электролитов
- •1.1. Основные понятия
- •1.2. Средняя ионная активность и средний коэффициент активности
- •1.3. Зависимость коэффициента активности от ионной силы раствора
- •Глава 2. Неравновесные явления в электролитах
- •2.1. Электропроводность растворов электролитов
- •2.1.1. Удельная электрическая проводимость растворов электролитов
- •2.1.2. Молярная электрическая проводимость растворов электролитов
- •2.1.3. Кондуктометрия
- •2.1.4. Примеры решения задач
- •2.1.5. Вопросы для самоконтроля
- •2.2. Электролиз. Числа переноса
- •2.2.1.Примеры решения задач
- •2.2.2. Вопросы для самоконтроля
- •Глава 3. Равновесные электродные процессы. Электродные потенциалы и эдс гальванических элементов. Потенциометрия
- •3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
- •3.2. Потенциалы электродов. Классификация электродов
- •3.2.1. Электроды нулевого рода (окислительно-восстановительные электроды)
- •3.2.2. Электроды первого рода
- •3.2.3. Электроды второго рода
- •3.2.4.Газовые электроды
- •3.3. Гальванические элементы и их эдс
- •3.3.1 Химические цепи
- •3.3.2. Примеры решения задач
- •3.3.2. Вопросы для самоконтроля
- •3.3.3. Концентрационные цепи
- •3.3.3.Примеры решения задач
- •3.3.4. Вопросы для самоконтроля
- •3.4. Экспериментальное определение эдс
- •3.5. Термодинамика обратимых электрохимических систем
- •3.5.1. Потенциометрия
- •3.5.2. Примеры решения задач
- •3.5.3. Вопросы для самоконтроля
- •Глава 4. Химическая кинетика
- •4.1. Основные понятия химической кинетики
- •4.2. Скорость химической реакции
- •4.2.1. Скорость химических реакций в закрытых системах
- •4.2.2. Скорость химических реакций в открытых системах
- •4.2.3. Факторы, влияющие на скорость реакции
- •4.3. Основной постулат химической кинетики. Закон действующих масс
- •Вопросы и задания для самоконтроля
- •4.4. Формальная кинетика
- •4.4.1. Формальная кинетика элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •4.4.1.2. Кинетика односторонних химических реакций второго порядка
- •4.4.1.3. Кинетика односторонних химических реакций третьего порядка
- •4.4.1.4. Кинетика односторонних химических реакций нулевого порядка
- •4.4.1.5.Примеры решения задач
- •4.4.2. Методы определения порядка реакций
- •4.4.2.1. Метод избыточных концентраций
- •4.4.2.2. Дифференциальные методы определения порядка реакции
- •1). Графический метод решения.
- •2). Аналитический метод решения.
- •3) Метод начальных скоростей Вант–Гоффа.
- •2). Графический метод решения.
- •4.4.2.3. Интегральные методы определения порядка реакции
- •1)Аналитический метод решения.
- •2) Графический метод решения
- •1). Аналитический метод решения.
- •2. Графический метод решения
- •4.5. Зависимость константы скорости реакции от температуры
- •4.5.1. Примеры решения задач
- •Вопросы и задания для самоконтроля.
- •4.6. Кинетика сложных реакций
- •4.6.1 Кинетика двусторонних (обратимых) химических реакций
- •4.6.2. Кинетика параллельных химических реакций
- •4.6.3. Кинетика последовательных химических реакций
- •4.6.4. Стационарное и квазистационарное протекание реакций
- •4.7. Кинетика химических реакций в открытых системах
- •4.7.1. Кинетика химических реакций в реакторе идеального смешения
- •4.7.2. Кинетика химических реакций в реакторе идеального вытеснения
- •4.8. Кинетика цепных реакций
- •4.8.1. Кинетика неразветвленных цепных реакций
- •4.8.2. Кинетика цепных реакций с разветвленными цепями
- •4.8.3. Примеры решения задач.
- •4.9. Кинетика фотохимических реакций
- •4.9.1. Примеры решения задач
- •4.10. Теории химической кинетики
- •4.10.1. Теория активных столкновений
- •4.10.2. Теория активированного комплекса
- •4.10.2.1 Термодинамический аспект теории активированного комплекса.
- •5.2.2. Примеры решения задач.
- •2 См3/(моль·с).
- •Глава 5. Катализ
- •5.1. Основные понятия и особенности катализа
- •Вопросы для самоконтроля
- •5.2. Классификация каталитических процессов
- •5.3. Свойства катализаторов.
- •3. Соотношения линейности Бренстеда-Поляни в катализе
- •Вопросы для самоконтроля
- •5.4 Механизмы гомогенных каталитических реакций
- •Вопросы для самоконтроля
- •5.5. Примеры гомогенных каталитических реакций
- •5.5.1. Кислотно-основной катализ
- •5.5.1.1. Кинетика кислотного катализа.
- •5.5.1.2. Кинетика основного катализа
- •5.5.1.3. Примеры решения задач
- •5.5.2 Катализ комплексными соединениями
- •Вопросы для самоконтроля
- •5.5.3. Ферментативный катализ
- •5.5.3.1. Кинетика ферментативных реакций
- •5.5.3.2. Влияние ингибиторов на кинетику ферментативных реакций
- •5.5.3.3. Примеры решения задач.
- •Вопросы для самоконтроля
- •5.6. Гетерогенный катализ
- •5.6.1. Свойства гетерогенных катализаторов
- •5.6.2. Приемы повышения каталитической активности катализаторов
- •5.5.2.1. Использование в катализе носителей
- •5.6.2.2. Использование в катализе промоторов
- •5.6.2.3. Каталитические яды
- •5.6.2.4. Смешанные катализаторы
- •5.6.3. Основные стадии гетерогенно-каталитических реакций
- •5.6.4. Порядки гетерогенно-каталитических реакций
- •5.6.5. Решение кинетических задач для гетерогенно-каталитических процессов
- •5.6.5.1. Примеры решения задач
- •5.6.6. Теории гетерогенного катализа
- •Содержание
- •Глава 5. Катализ 141
- •Физическая химиЯ Часть ιι
5.5.1.1. Кинетика кислотного катализа.
Решение кинетической задачи рассмотрим на примере реакций специфического кислотного5 катализа.
Пусть взаимодействие субстрата (S) и катализатора (H3O+) протекает по схеме:
![]() равновесная стадия процесса
равновесная стадия процесса
![]() лимитирующая
стадия
лимитирующая
стадия
Скорость лимитирующей стадии определяет скорость протекания процесса:
v = k2 cSH+, (5.23)
где k2 = k’2·c![]()
Концентрация протонизированного субстрата (c SH+) составляет какую–то долю (α) от исходной концентрации субстрата (cS0):
α = cSH+/cS0 или cSH+ = α· cS0. (5.24)
Учитывая это, уравнение для скорости лимитирующей стадии будет равно:
v = k2 α· cS0. (5.25)
Степень протонизации субстрата (α) можно оценить из константы равновесия первой стадии процесса:
 ,
или
,
или  (5.26)
(5.26)
Откуда
 или
или  (5.27)
(5.27)
где
 –
кислотность среды.
–
кислотность среды.
Преобразуем уравнение (5.27), используя свойство дробей:
 (5.28)
(5.28)
Так как
![]() ,
то степень протонизации субстрата α
равна:
,
то степень протонизации субстрата α
равна:
 (5.29)
(5.29)
Подставляя уравнение (5.29) в (5.25) получим выражение для скорости лимитирующей стадии процесса:
 , (5.30)
, (5.30)
Как видно из уравнения (5.30), определяемая из опытных данных эффективная константа скорости зависит от кислотности среды:
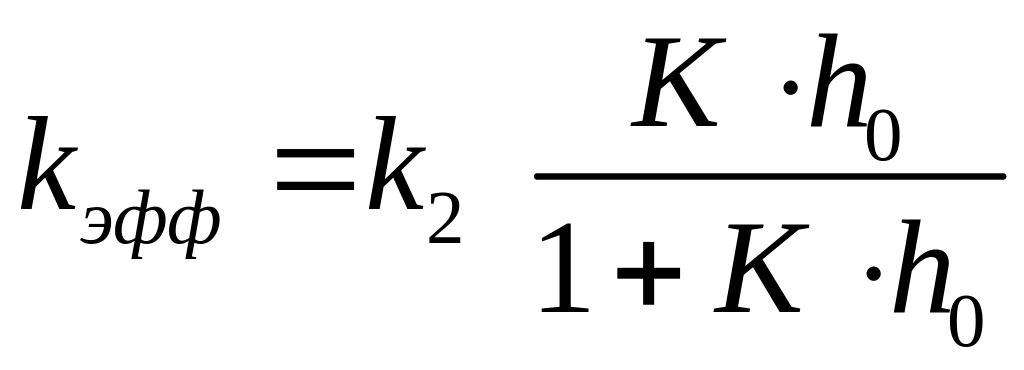 (5.31)
(5.31)
Проведем анализ уравнения (5.31).
Если равновесие первой стадии устанавливается быстро, то константа равновесия К достаточно большая величина по сравнению с 1, тогда
 .
.Если равновесие первой стадии устанавливается медленно, то константа равновесия (К) маленькая величина и слагаемым К·h0 в знаменателе можно пренебречь. В этом случае уравнение (5.31) имеет вид:
![]() .
.
После логарифмирования имеем:
![]() , (5.32)
, (5.32)
где
![]() –
функция кислотности.
–
функция кислотности.
Построив по экспериментальным данным график в координатах lgkэфф – рН, можно оценить значение произведения k2·K. Если известна константа равновесия первой стадии, то можно определить k2.·
Если константа равновесия К – средняя величина, то уравнение (5.31) можно привести к виду прямой линии:
 (5.33)
(5.33)
График, построенный по опытным данным
в координатах
![]() ,
в случае соответствия этой модели
реальной кинетике процесса должен
изображаться прямой линией. Зная угловой
коэффициент прямой и отрезок на оси
ординат, можно вычислить
,
в случае соответствия этой модели
реальной кинетике процесса должен
изображаться прямой линией. Зная угловой
коэффициент прямой и отрезок на оси
ординат, можно вычислить
![]() и К.
и К.
5.5.1.2. Кинетика основного катализа
Решение кинетической задачи рассмотрим на примере реакций специфического основного катализа.
Пусть взаимодействие протонизированного субстрата (SН) и катализатора (ОH–, Н2O, Cl–) протекает следующим образом:
![]() ,
,
![]() ,
,
![]() .
.
Каждая из этих стадий может лимитировать скорость протекания всего процесса.
Заключительные стадии процесса являются равновесными, так как протекают значительно быстрее:
![]() ,
,
![]() ,
,
![]() .
.
Таким образом, протонизированный субстрат (SH) взаимодействует с тремя разными катализаторами (параллельные химические реакции), поэтому скорость его расходования будет равна сумме скоростей на отдельных стадиях:
vSH = v1+ v2+ v3
или
vSH=![]() , (5.34)
, (5.34)
где
![]()
![]() (5.35)
(5.35)
Кажущаяся константа скорости определяется
из экспериментальных данных. Изучая,
как эта константа меняется от
![]() можно оценить каждую из каталитических
констант:
можно оценить каждую из каталитических
констант:
![]() .
.
