
- •Н. А. Колпакова, с. В. Романенко, в. А. Колпаков Физическая химия Часть ιι
- •Глава 1. Термодинамика растворов электролитов
- •1.1. Основные понятия
- •1.2. Средняя ионная активность и средний коэффициент активности
- •1.3. Зависимость коэффициента активности от ионной силы раствора
- •Глава 2. Неравновесные явления в электролитах
- •2.1. Электропроводность растворов электролитов
- •2.1.1. Удельная электрическая проводимость растворов электролитов
- •2.1.2. Молярная электрическая проводимость растворов электролитов
- •2.1.3. Кондуктометрия
- •2.1.4. Примеры решения задач
- •2.1.5. Вопросы для самоконтроля
- •2.2. Электролиз. Числа переноса
- •2.2.1.Примеры решения задач
- •2.2.2. Вопросы для самоконтроля
- •Глава 3. Равновесные электродные процессы. Электродные потенциалы и эдс гальванических элементов. Потенциометрия
- •3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
- •3.2. Потенциалы электродов. Классификация электродов
- •3.2.1. Электроды нулевого рода (окислительно-восстановительные электроды)
- •3.2.2. Электроды первого рода
- •3.2.3. Электроды второго рода
- •3.2.4.Газовые электроды
- •3.3. Гальванические элементы и их эдс
- •3.3.1 Химические цепи
- •3.3.2. Примеры решения задач
- •3.3.2. Вопросы для самоконтроля
- •3.3.3. Концентрационные цепи
- •3.3.3.Примеры решения задач
- •3.3.4. Вопросы для самоконтроля
- •3.4. Экспериментальное определение эдс
- •3.5. Термодинамика обратимых электрохимических систем
- •3.5.1. Потенциометрия
- •3.5.2. Примеры решения задач
- •3.5.3. Вопросы для самоконтроля
- •Глава 4. Химическая кинетика
- •4.1. Основные понятия химической кинетики
- •4.2. Скорость химической реакции
- •4.2.1. Скорость химических реакций в закрытых системах
- •4.2.2. Скорость химических реакций в открытых системах
- •4.2.3. Факторы, влияющие на скорость реакции
- •4.3. Основной постулат химической кинетики. Закон действующих масс
- •Вопросы и задания для самоконтроля
- •4.4. Формальная кинетика
- •4.4.1. Формальная кинетика элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •4.4.1.2. Кинетика односторонних химических реакций второго порядка
- •4.4.1.3. Кинетика односторонних химических реакций третьего порядка
- •4.4.1.4. Кинетика односторонних химических реакций нулевого порядка
- •4.4.1.5.Примеры решения задач
- •4.4.2. Методы определения порядка реакций
- •4.4.2.1. Метод избыточных концентраций
- •4.4.2.2. Дифференциальные методы определения порядка реакции
- •1). Графический метод решения.
- •2). Аналитический метод решения.
- •3) Метод начальных скоростей Вант–Гоффа.
- •2). Графический метод решения.
- •4.4.2.3. Интегральные методы определения порядка реакции
- •1)Аналитический метод решения.
- •2) Графический метод решения
- •1). Аналитический метод решения.
- •2. Графический метод решения
- •4.5. Зависимость константы скорости реакции от температуры
- •4.5.1. Примеры решения задач
- •Вопросы и задания для самоконтроля.
- •4.6. Кинетика сложных реакций
- •4.6.1 Кинетика двусторонних (обратимых) химических реакций
- •4.6.2. Кинетика параллельных химических реакций
- •4.6.3. Кинетика последовательных химических реакций
- •4.6.4. Стационарное и квазистационарное протекание реакций
- •4.7. Кинетика химических реакций в открытых системах
- •4.7.1. Кинетика химических реакций в реакторе идеального смешения
- •4.7.2. Кинетика химических реакций в реакторе идеального вытеснения
- •4.8. Кинетика цепных реакций
- •4.8.1. Кинетика неразветвленных цепных реакций
- •4.8.2. Кинетика цепных реакций с разветвленными цепями
- •4.8.3. Примеры решения задач.
- •4.9. Кинетика фотохимических реакций
- •4.9.1. Примеры решения задач
- •4.10. Теории химической кинетики
- •4.10.1. Теория активных столкновений
- •4.10.2. Теория активированного комплекса
- •4.10.2.1 Термодинамический аспект теории активированного комплекса.
- •5.2.2. Примеры решения задач.
- •2 См3/(моль·с).
- •Глава 5. Катализ
- •5.1. Основные понятия и особенности катализа
- •Вопросы для самоконтроля
- •5.2. Классификация каталитических процессов
- •5.3. Свойства катализаторов.
- •3. Соотношения линейности Бренстеда-Поляни в катализе
- •Вопросы для самоконтроля
- •5.4 Механизмы гомогенных каталитических реакций
- •Вопросы для самоконтроля
- •5.5. Примеры гомогенных каталитических реакций
- •5.5.1. Кислотно-основной катализ
- •5.5.1.1. Кинетика кислотного катализа.
- •5.5.1.2. Кинетика основного катализа
- •5.5.1.3. Примеры решения задач
- •5.5.2 Катализ комплексными соединениями
- •Вопросы для самоконтроля
- •5.5.3. Ферментативный катализ
- •5.5.3.1. Кинетика ферментативных реакций
- •5.5.3.2. Влияние ингибиторов на кинетику ферментативных реакций
- •5.5.3.3. Примеры решения задач.
- •Вопросы для самоконтроля
- •5.6. Гетерогенный катализ
- •5.6.1. Свойства гетерогенных катализаторов
- •5.6.2. Приемы повышения каталитической активности катализаторов
- •5.5.2.1. Использование в катализе носителей
- •5.6.2.2. Использование в катализе промоторов
- •5.6.2.3. Каталитические яды
- •5.6.2.4. Смешанные катализаторы
- •5.6.3. Основные стадии гетерогенно-каталитических реакций
- •5.6.4. Порядки гетерогенно-каталитических реакций
- •5.6.5. Решение кинетических задач для гетерогенно-каталитических процессов
- •5.6.5.1. Примеры решения задач
- •5.6.6. Теории гетерогенного катализа
- •Содержание
- •Глава 5. Катализ 141
- •Физическая химиЯ Часть ιι
3. Соотношения линейности Бренстеда-Поляни в катализе
Перспективный подход к предвидению каталитического действия твердых катализаторов основан на использовании соотношения линейности Бренстеда-Поляни, суть и основное значение которого состоит в том, что оно устанавливает связь между кинетическими (Е, k, ) и термодинамическими ( ) величинами, характерными для данного каталитического процесса.
Разные формы этого соотношения имеют вид:
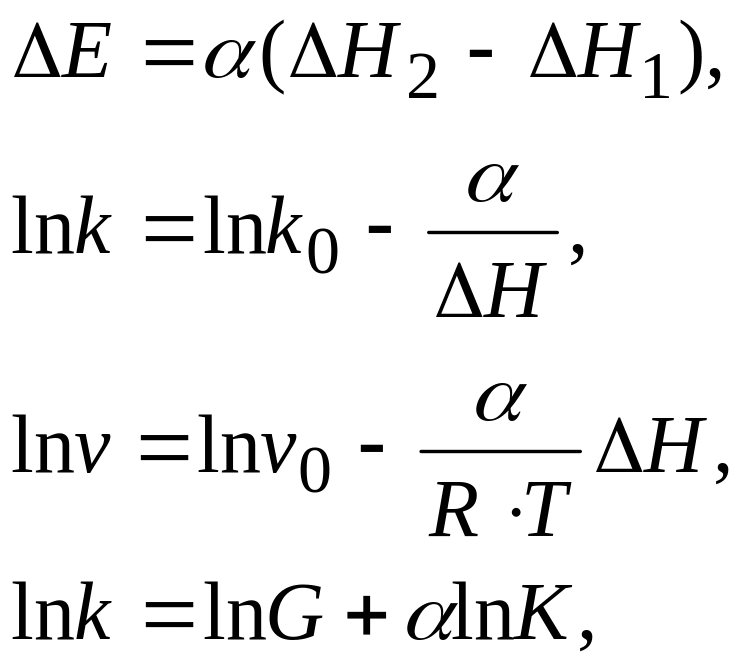 (5.12)
(5.12)
где , lnk0, lnv0 – постоянные эмпирические коэффициенты в ряду сходных катализаторов для данной реакции и в ряду однотипных реакций для данного катализатора; k, v – константа скорости и скорость реакции, К –константа равновесия, G – энергия Гиббса.
Тепловой эффект реакции () и энергия Гиббса (G) отражают величину энергии разрыва связи катализатор-субстрат.
Рассмотрим для примера реакцию окисления на оксидах металлов в качестве катализатора. Соотношение Бренстеда-Поляни используется в форме:
Е = Е0 +
![]() ,
(5.13)
,
(5.13)
где Е0 и – постоянные, одинаковые в ряду разных оксидов для заданной реакции окисления. Энергия активации реакции для разных катализаторов (Е) и теплота адсорбции кислорода на катализаторе ( ) (равная энергии связи кислорода (Q) с металлом).
Строится график в координатах Е – , определяется и Е0, зная которые можно рассчитать Е по известному или наоборот для катализаторов, с которыми не проводились опыты. По этим величинам можно судить об активности катализаторов. Корреляция между каталитической активностью и энергией связи кислорода справедлива не только для простых оксидов, но и для более сложных соединений типа шпинелей, солей ванадатов, молибдатов, смешанных оксидов и т.д.
Вопросы для самоконтроля
Что является мерой каталитической активности в гомогенном и ферментативном катализе? Каков порядок этой величины в каждом из типов катализа?
Какие величины используют для оценки эффективности катализатора в гетерогенном катализе?
В чем различие терминов «интегральная» и «дифференциальная» селективность? Ответ поясните.
Во сколько раз увеличиться скорость химической реакции при изменении активационного барьера на: а) 4 кДж/моль;б) 40 кДж/моль.
5.4 Механизмы гомогенных каталитических реакций
Промежуточное химическое взаимодействие реагентов с катализатором может протекать по двум видам механизма – слитно и раздельно.
При слитном механизме с состав активированного комплекса (промежуточного соединения) входят, наряду с катализатором, все реагирующие вещества и реакция идёт по схеме:
1. A + B
AB![]()
D + E без
катализатора,
D + E без
катализатора,
2. A + B +K ABK D + E + K c катализатором.
Увеличение скорости реакции в этом случае объясняется уменьшением энергии активации процесса
При раздельном механизме каталитический процесс осуществляется поэтапно:
3.
![]() .
.
4.
![]() .
.
Все соединения со значком ( ) означают активированный комплекс системы, находящейся в переходном состоянии. В этих реакциях суммарная энергия активации реакции необязательно должна уменьшаться, а скорость процесса растёт за счёт роста энтропийного фактора, так как при этом растёт количество стадий и упрощается строение активированных комплексов. Реакции с раздельным и слитным механизмом протекают при разных температурах; первые – при 600 – 800 К, а вторые – в области 300 - 400 К.
Как правило, катализатор снижает энергию активации реакции и ускоряет её. Замедлить реакцию (не цепную) катализатор не может, так как если в присутствии катализатора энергия активации растёт, то реакция пойдёт по обычному, не каталитическому пути и скорость её окажется прежней. Замедляющее действие катализатор может оказывать на цепную реакцию, когда он ускоряет стадию обрыва цепи.
Рассмотрим реакцию, протекающую по раздельному механизму [см. уравнения (3), (4)]. Согласно теории активированного комплекса, скорость реакции определяется скоростью распада комплекса на конечные продукты:
![]() . (5.14)
. (5.14)
В соответствии с принципом стационарности:
![]() . (5.15)
. (5.15)
Откуда:
![]() , (6.16)
, (6.16)
![]() , (5.17)
, (5.17)
![]() . (5.18)
. (5.18)
Подставляя (5.18) в (5.16) и затем в (5.14), находим:
 . (5.19)
. (5.19)
Это уравнение лежит в основе кинетики гетерогенно–каталитических реакций.
Из (5.19) видно, что скорость образования продукта реакции прямо пропорциональна концентрации катализатора сК, что хорошо согласуется с опытом.
Характерные частные случаи:
1) если k2k3,
т.е. константа скорости распада
промежуточного соединения АК на исходные
реагенты значительно превышает константу
скорости образования активированного
комплекса AKB![]() ,
то
,
то
![]() , (5.20)
, (5.20)
т.е. скорость реакции прямо пропорциональна концентрации катализатора и реагентов. Промежуточное вещество (АК) называется промежуточным веществом Аррениуса.
2) если k2 k3 , тогда всё количество промежуточного вещества превращается в конечные продукты и скорость реакции пропорциональна концентрации вещества (A), из которого образуется вещество (АК):
![]() . (5.21)
. (5.21)
Промежуточное вещество в этом случае носит название промежуточное вещество Вант Гоффа. Например, реакция окисления тиосульфата перекисью водорода в кислой среде с I– ионами
2S2O32- + H2O2 + 2H+ S4O62- + 2H2O
идёт по стадиям:
I– + H2O2 IO- + H2O,
I-+ IO– + 2H+ I2 + H2O,
I2 + 2S2O32– S4O62– + 2I–.
В этом случае IO– – промежуточное вещество Вант Гоффа. Если же в качестве катализатора взять молибденовую кислоту, то конечным продуктом её будут сульфат ионы и вода:
MoO4 + 4H2O2 [MoO8]2– + 4H2O,
[MoO8]2– + S2O32– +H2O 2SO42– + 2H+ + [MoO4]2–,
причём [MoO8]2– – является промежуточным веществом Аррениуса.
