
- •Н. А. Колпакова, с. В. Романенко, в. А. Колпаков Физическая химия Часть ιι
- •Глава 1. Термодинамика растворов электролитов
- •1.1. Основные понятия
- •1.2. Средняя ионная активность и средний коэффициент активности
- •1.3. Зависимость коэффициента активности от ионной силы раствора
- •Глава 2. Неравновесные явления в электролитах
- •2.1. Электропроводность растворов электролитов
- •2.1.1. Удельная электрическая проводимость растворов электролитов
- •2.1.2. Молярная электрическая проводимость растворов электролитов
- •2.1.3. Кондуктометрия
- •2.1.4. Примеры решения задач
- •2.1.5. Вопросы для самоконтроля
- •2.2. Электролиз. Числа переноса
- •2.2.1.Примеры решения задач
- •2.2.2. Вопросы для самоконтроля
- •Глава 3. Равновесные электродные процессы. Электродные потенциалы и эдс гальванических элементов. Потенциометрия
- •3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
- •3.2. Потенциалы электродов. Классификация электродов
- •3.2.1. Электроды нулевого рода (окислительно-восстановительные электроды)
- •3.2.2. Электроды первого рода
- •3.2.3. Электроды второго рода
- •3.2.4.Газовые электроды
- •3.3. Гальванические элементы и их эдс
- •3.3.1 Химические цепи
- •3.3.2. Примеры решения задач
- •3.3.2. Вопросы для самоконтроля
- •3.3.3. Концентрационные цепи
- •3.3.3.Примеры решения задач
- •3.3.4. Вопросы для самоконтроля
- •3.4. Экспериментальное определение эдс
- •3.5. Термодинамика обратимых электрохимических систем
- •3.5.1. Потенциометрия
- •3.5.2. Примеры решения задач
- •3.5.3. Вопросы для самоконтроля
- •Глава 4. Химическая кинетика
- •4.1. Основные понятия химической кинетики
- •4.2. Скорость химической реакции
- •4.2.1. Скорость химических реакций в закрытых системах
- •4.2.2. Скорость химических реакций в открытых системах
- •4.2.3. Факторы, влияющие на скорость реакции
- •4.3. Основной постулат химической кинетики. Закон действующих масс
- •Вопросы и задания для самоконтроля
- •4.4. Формальная кинетика
- •4.4.1. Формальная кинетика элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •4.4.1.2. Кинетика односторонних химических реакций второго порядка
- •4.4.1.3. Кинетика односторонних химических реакций третьего порядка
- •4.4.1.4. Кинетика односторонних химических реакций нулевого порядка
- •4.4.1.5.Примеры решения задач
- •4.4.2. Методы определения порядка реакций
- •4.4.2.1. Метод избыточных концентраций
- •4.4.2.2. Дифференциальные методы определения порядка реакции
- •1). Графический метод решения.
- •2). Аналитический метод решения.
- •3) Метод начальных скоростей Вант–Гоффа.
- •2). Графический метод решения.
- •4.4.2.3. Интегральные методы определения порядка реакции
- •1)Аналитический метод решения.
- •2) Графический метод решения
- •1). Аналитический метод решения.
- •2. Графический метод решения
- •4.5. Зависимость константы скорости реакции от температуры
- •4.5.1. Примеры решения задач
- •Вопросы и задания для самоконтроля.
- •4.6. Кинетика сложных реакций
- •4.6.1 Кинетика двусторонних (обратимых) химических реакций
- •4.6.2. Кинетика параллельных химических реакций
- •4.6.3. Кинетика последовательных химических реакций
- •4.6.4. Стационарное и квазистационарное протекание реакций
- •4.7. Кинетика химических реакций в открытых системах
- •4.7.1. Кинетика химических реакций в реакторе идеального смешения
- •4.7.2. Кинетика химических реакций в реакторе идеального вытеснения
- •4.8. Кинетика цепных реакций
- •4.8.1. Кинетика неразветвленных цепных реакций
- •4.8.2. Кинетика цепных реакций с разветвленными цепями
- •4.8.3. Примеры решения задач.
- •4.9. Кинетика фотохимических реакций
- •4.9.1. Примеры решения задач
- •4.10. Теории химической кинетики
- •4.10.1. Теория активных столкновений
- •4.10.2. Теория активированного комплекса
- •4.10.2.1 Термодинамический аспект теории активированного комплекса.
- •5.2.2. Примеры решения задач.
- •2 См3/(моль·с).
- •Глава 5. Катализ
- •5.1. Основные понятия и особенности катализа
- •Вопросы для самоконтроля
- •5.2. Классификация каталитических процессов
- •5.3. Свойства катализаторов.
- •3. Соотношения линейности Бренстеда-Поляни в катализе
- •Вопросы для самоконтроля
- •5.4 Механизмы гомогенных каталитических реакций
- •Вопросы для самоконтроля
- •5.5. Примеры гомогенных каталитических реакций
- •5.5.1. Кислотно-основной катализ
- •5.5.1.1. Кинетика кислотного катализа.
- •5.5.1.2. Кинетика основного катализа
- •5.5.1.3. Примеры решения задач
- •5.5.2 Катализ комплексными соединениями
- •Вопросы для самоконтроля
- •5.5.3. Ферментативный катализ
- •5.5.3.1. Кинетика ферментативных реакций
- •5.5.3.2. Влияние ингибиторов на кинетику ферментативных реакций
- •5.5.3.3. Примеры решения задач.
- •Вопросы для самоконтроля
- •5.6. Гетерогенный катализ
- •5.6.1. Свойства гетерогенных катализаторов
- •5.6.2. Приемы повышения каталитической активности катализаторов
- •5.5.2.1. Использование в катализе носителей
- •5.6.2.2. Использование в катализе промоторов
- •5.6.2.3. Каталитические яды
- •5.6.2.4. Смешанные катализаторы
- •5.6.3. Основные стадии гетерогенно-каталитических реакций
- •5.6.4. Порядки гетерогенно-каталитических реакций
- •5.6.5. Решение кинетических задач для гетерогенно-каталитических процессов
- •5.6.5.1. Примеры решения задач
- •5.6.6. Теории гетерогенного катализа
- •Содержание
- •Глава 5. Катализ 141
- •Физическая химиЯ Часть ιι
4.10.2.1 Термодинамический аспект теории активированного комплекса.
Если константа скорости имеет размерность
см3/мольс и
все вещества находятся в стандартном
состоянии (![]() =1
моль/см3), то для реакции, протекающей
при постоянном объеме:
=1
моль/см3), то для реакции, протекающей
при постоянном объеме:
![]() . (4.219)
. (4.219)
где
![]() – стандартная энергия активации
Гельмгольца;
– стандартная энергия активации
Гельмгольца;
![]() –
энтропия активации при стандартном
состоянии (
=1
моль/см3);
–
энтропия активации при стандартном
состоянии (
=1
моль/см3);![]() –
внутренняя энергия активации;
–
внутренняя энергия активации;
![]() =
(1-n ) – изменение числа
молекул при образовании активированного
комплекса; n – число
вступающих в реакцию молекул.
=
(1-n ) – изменение числа
молекул при образовании активированного
комплекса; n – число
вступающих в реакцию молекул.
Множитель
![]() в
формуле (4.219) необходим, чтобы получить
одинаковую размерность в правой и левой
частях равенства.
в
формуле (4.219) необходим, чтобы получить
одинаковую размерность в правой и левой
частях равенства.
В справочнике физико-химических величин
нет значений внутренних энергий
активации образования молекул
активированного комплекса. Поэтому
вместо
![]() при
расчетах констант скоростей приходится
пользоваться опытными энергиями
активации. Чтобы найти связь между этими
величинами, прологарифмируем уравнение
(4.218)
при
расчетах констант скоростей приходится
пользоваться опытными энергиями
активации. Чтобы найти связь между этими
величинами, прологарифмируем уравнение
(4.218)
![]() , (4.220)
, (4.220)
а затем продифференцируем (4.220) по температуре и сравним с уравнением Аррениуса (4.65):
![]() . (4.221)
. (4.221)
Из сравнения следует, что
![]() (4.222)
(4.222)
Подставив (4.222) в (4.219), получим выражение для константы скорости на основе теории активированного комплекса для реакции, протекающей при постоянном объеме:
 . (4.223)
. (4.223)
Множитель
![]() равен
предэкспоненциальному множителю
уравнения Аррениуса, а энтропийный
множитель это стерический фактор Р:
равен
предэкспоненциальному множителю
уравнения Аррениуса, а энтропийный
множитель это стерический фактор Р:
Р =
![]() . (4.224)
. (4.224)
Если реакция протекает в газовой фазе, то в качестве стандартного состояния используют р0 = 1 атм. Тогда
![]() . (4.225)
. (4.225)
Поэтому энтальпия активации связана с опытной энергией активации соотношением:
![]() . (4.226)
. (4.226)
В этом случае для расчета констант из
таблиц берут обычно значения энтропии
веществ, стандартизованные по давлению,
в связи с чем приходится переходить от
величин
к величинам
![]() .
В применении к газовым реакциям будет
иметь место соотношение:
.
В применении к газовым реакциям будет
иметь место соотношение:
![]() , (4.227)
, (4.227)
Если
![]() ,
то
,
то
![]() ,
где R3 = 82
см3∙атм/моль·К.
,
где R3 = 82
см3∙атм/моль·К.
Подставив (4.225), (4.227) в уравнение (4.219), получим выражение для расчета константы скорости в случае реакции, протекающей в газовой фазе:
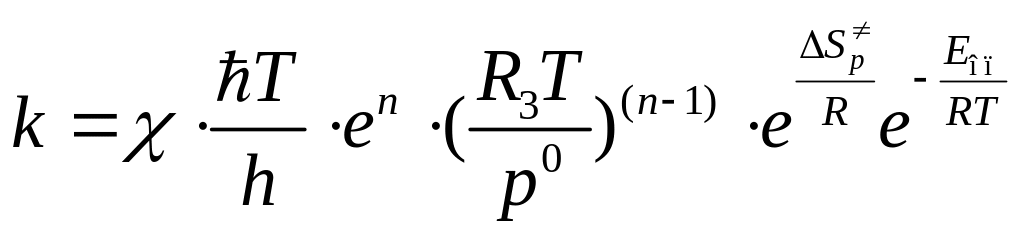 см3/моль·с. (4.228)
см3/моль·с. (4.228)
Из формулы (4.228) нетрудно получить формулу для расчета :
 Дж/мольК. (5.36 4.229)
Дж/мольК. (5.36 4.229)
Рассмотрим применение формулы (4.228) к описанию кинетики различных реакций.
1. Для мономолекулярной реакции, в которой образование активированного комплекса происходит без изменения числа частиц (n=1):
 . (4.230)
. (4.230)
Значение опытной энергии активации (Е) связано с энтальпией активации (n=1) соотношением:
![]() . (4.231)
. (4.231)
Для мономолекулярных реакций
![]() , а стерический фактор Р вычисляется
по формуле (4.223).
, а стерический фактор Р вычисляется
по формуле (4.223).
2. В случае бимолекулярной реакции (n=2) из двух молекул газа образуется одна молекула активированного комплекса, поэтому константа скорости может быть вычислена по формуле:
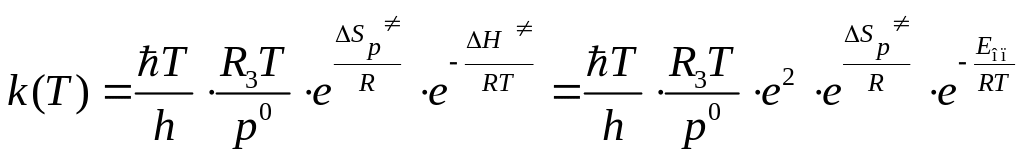 . (4.232)
. (4.232)
Для бимолекулярной реакции энтальпия активации связана с опытной энергией активации соотношением (р0 =1 атм):
![]() . (4.233)
. (4.233)
![]() . (4.234)
. (4.234)
![]() . (4.235)
. (4.235)
3. Для реакций, протекающих в растворах, константу равновесия выражают через энергию Гельмгольца образования активированного комплекса:
![]() =
=
![]() . (4.236)
. (4.236)
