
- •Н. А. Колпакова, с. В. Романенко, в. А. Колпаков Физическая химия Часть ιι
- •Глава 1. Термодинамика растворов электролитов
- •1.1. Основные понятия
- •1.2. Средняя ионная активность и средний коэффициент активности
- •1.3. Зависимость коэффициента активности от ионной силы раствора
- •Глава 2. Неравновесные явления в электролитах
- •2.1. Электропроводность растворов электролитов
- •2.1.1. Удельная электрическая проводимость растворов электролитов
- •2.1.2. Молярная электрическая проводимость растворов электролитов
- •2.1.3. Кондуктометрия
- •2.1.4. Примеры решения задач
- •2.1.5. Вопросы для самоконтроля
- •2.2. Электролиз. Числа переноса
- •2.2.1.Примеры решения задач
- •2.2.2. Вопросы для самоконтроля
- •Глава 3. Равновесные электродные процессы. Электродные потенциалы и эдс гальванических элементов. Потенциометрия
- •3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
- •3.2. Потенциалы электродов. Классификация электродов
- •3.2.1. Электроды нулевого рода (окислительно-восстановительные электроды)
- •3.2.2. Электроды первого рода
- •3.2.3. Электроды второго рода
- •3.2.4.Газовые электроды
- •3.3. Гальванические элементы и их эдс
- •3.3.1 Химические цепи
- •3.3.2. Примеры решения задач
- •3.3.2. Вопросы для самоконтроля
- •3.3.3. Концентрационные цепи
- •3.3.3.Примеры решения задач
- •3.3.4. Вопросы для самоконтроля
- •3.4. Экспериментальное определение эдс
- •3.5. Термодинамика обратимых электрохимических систем
- •3.5.1. Потенциометрия
- •3.5.2. Примеры решения задач
- •3.5.3. Вопросы для самоконтроля
- •Глава 4. Химическая кинетика
- •4.1. Основные понятия химической кинетики
- •4.2. Скорость химической реакции
- •4.2.1. Скорость химических реакций в закрытых системах
- •4.2.2. Скорость химических реакций в открытых системах
- •4.2.3. Факторы, влияющие на скорость реакции
- •4.3. Основной постулат химической кинетики. Закон действующих масс
- •Вопросы и задания для самоконтроля
- •4.4. Формальная кинетика
- •4.4.1. Формальная кинетика элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •4.4.1.2. Кинетика односторонних химических реакций второго порядка
- •4.4.1.3. Кинетика односторонних химических реакций третьего порядка
- •4.4.1.4. Кинетика односторонних химических реакций нулевого порядка
- •4.4.1.5.Примеры решения задач
- •4.4.2. Методы определения порядка реакций
- •4.4.2.1. Метод избыточных концентраций
- •4.4.2.2. Дифференциальные методы определения порядка реакции
- •1). Графический метод решения.
- •2). Аналитический метод решения.
- •3) Метод начальных скоростей Вант–Гоффа.
- •2). Графический метод решения.
- •4.4.2.3. Интегральные методы определения порядка реакции
- •1)Аналитический метод решения.
- •2) Графический метод решения
- •1). Аналитический метод решения.
- •2. Графический метод решения
- •4.5. Зависимость константы скорости реакции от температуры
- •4.5.1. Примеры решения задач
- •Вопросы и задания для самоконтроля.
- •4.6. Кинетика сложных реакций
- •4.6.1 Кинетика двусторонних (обратимых) химических реакций
- •4.6.2. Кинетика параллельных химических реакций
- •4.6.3. Кинетика последовательных химических реакций
- •4.6.4. Стационарное и квазистационарное протекание реакций
- •4.7. Кинетика химических реакций в открытых системах
- •4.7.1. Кинетика химических реакций в реакторе идеального смешения
- •4.7.2. Кинетика химических реакций в реакторе идеального вытеснения
- •4.8. Кинетика цепных реакций
- •4.8.1. Кинетика неразветвленных цепных реакций
- •4.8.2. Кинетика цепных реакций с разветвленными цепями
- •4.8.3. Примеры решения задач.
- •4.9. Кинетика фотохимических реакций
- •4.9.1. Примеры решения задач
- •4.10. Теории химической кинетики
- •4.10.1. Теория активных столкновений
- •4.10.2. Теория активированного комплекса
- •4.10.2.1 Термодинамический аспект теории активированного комплекса.
- •5.2.2. Примеры решения задач.
- •2 См3/(моль·с).
- •Глава 5. Катализ
- •5.1. Основные понятия и особенности катализа
- •Вопросы для самоконтроля
- •5.2. Классификация каталитических процессов
- •5.3. Свойства катализаторов.
- •3. Соотношения линейности Бренстеда-Поляни в катализе
- •Вопросы для самоконтроля
- •5.4 Механизмы гомогенных каталитических реакций
- •Вопросы для самоконтроля
- •5.5. Примеры гомогенных каталитических реакций
- •5.5.1. Кислотно-основной катализ
- •5.5.1.1. Кинетика кислотного катализа.
- •5.5.1.2. Кинетика основного катализа
- •5.5.1.3. Примеры решения задач
- •5.5.2 Катализ комплексными соединениями
- •Вопросы для самоконтроля
- •5.5.3. Ферментативный катализ
- •5.5.3.1. Кинетика ферментативных реакций
- •5.5.3.2. Влияние ингибиторов на кинетику ферментативных реакций
- •5.5.3.3. Примеры решения задач.
- •Вопросы для самоконтроля
- •5.6. Гетерогенный катализ
- •5.6.1. Свойства гетерогенных катализаторов
- •5.6.2. Приемы повышения каталитической активности катализаторов
- •5.5.2.1. Использование в катализе носителей
- •5.6.2.2. Использование в катализе промоторов
- •5.6.2.3. Каталитические яды
- •5.6.2.4. Смешанные катализаторы
- •5.6.3. Основные стадии гетерогенно-каталитических реакций
- •5.6.4. Порядки гетерогенно-каталитических реакций
- •5.6.5. Решение кинетических задач для гетерогенно-каталитических процессов
- •5.6.5.1. Примеры решения задач
- •5.6.6. Теории гетерогенного катализа
- •Содержание
- •Глава 5. Катализ 141
- •Физическая химиЯ Часть ιι
1.3. Зависимость коэффициента активности от ионной силы раствора
Средний коэффициент активности бинарного z+, z- -валентного
электролита можно рассчитать по выведенному Дебаем и Хюккелем уравнению
![]() ,
(1.15)
,
(1.15)
где I
– ионная сила
раствора;
![]() ,
,
где
![]() –
диэлектрическая проницаемость
растворителя.
–
диэлектрическая проницаемость
растворителя.
В разбавленном водном растворе при 298 К =78,3 и А = 0,509.
Уравнение (1.15) применимо только к сильно разбавленным электролитам и называется предельным законом Дебая – Хюккеля. Этот закон формулируется следующим образом.
При данной ионной силе раствора средний коэффициент активности электролита в предельно разбавленном растворе является величиной постоянной и не зависит от природы других электролитов в растворе.
Таким образом, в
предельном законе Дебая
–Хюккеля получает теоретическое
обоснование правило ионной силы. Закон
устанавливает линейную зависимость
![]() от
от
![]() .
Однако, этот закон соблюдается лишь в
растворах с ионной силой порядка 10-2
и меньше.
.
Однако, этот закон соблюдается лишь в
растворах с ионной силой порядка 10-2
и меньше.
С ростом концентрации
раствора электролита, отклонения опытных
значений
![]() от вычисленных
по уравнению (1.15) увеличиваются.
от вычисленных
по уравнению (1.15) увеличиваются.
Для растворов с ионной силой до 0,1 справедливо уравнение
 ,
(1.16)
,
(1.16)
где В – теоретический коэффициент, равный для водных растворов при 298 К В = 0,33 · 108;
а – средний эффективный диаметр ионов, находят из опыта. По порядку величины он близок к размеру ионов (10-8 см).
Удовлетворительное согласие с опытом в широком интервале концентраций растворов электролитов для расчета среднего коэффициента активности дает полуэмпирическое уравнение
 . (1.17)
. (1.17)
Слагаемое
![]() вводится для
учета поляризации дипольных молекул
растворителя
вокруг иона растворенного вещества,
что равноценно уменьшению диэлектрической
проницаемости вблизи иона, а также для
учета размеров сольватных оболочек
ионов. Постоянный коэффициент
вводится для
учета поляризации дипольных молекул
растворителя
вокруг иона растворенного вещества,
что равноценно уменьшению диэлектрической
проницаемости вблизи иона, а также для
учета размеров сольватных оболочек
ионов. Постоянный коэффициент
![]() подбирается опытным путем.
подбирается опытным путем.
К сожалению, до сих пор еще не существует достаточно строгой теории, которая бы позволила рассчитать в согласии с опытом зависимость среднего коэффициента активности ионов электролита от концентрации в области концентрированных растворов.
Глава 2. Неравновесные явления в электролитах
2.1. Электропроводность растворов электролитов
2.1.1. Удельная электрическая проводимость растворов электролитов
Так как в растворах электролитов присутствуют заряженные частицы, то, при наложении электрического поля, растворы электролитов способны проводить электрический ток. Способность растворов электролитов проводить электрический ток обеспечивается за счет миграции ионов, присутствующих в данном растворе.
Мерой способности веществ проводить электрический ток является удельная электрическая проводимость æ — величина, обратная удельному электрическому сопротивлению:
æ
![]() . (2.1)
. (2.1)
Так как
![]() то æ
то æ![]() , (2.2)
, (2.2)
где r -удельное
электрическое сопротивление, Ом×м;
S - поперечное сечение, м2;
![]() -
длина проводника, м; æ
- удельная электрическая проводимость,
Ом–1м–1=См·м–1
(Ом–1 = См -
Сименс).
-
длина проводника, м; æ
- удельная электрическая проводимость,
Ом–1м–1=См·м–1
(Ом–1 = См -
Сименс).
Удельная электрическая проводимость раствора электролита - это электрическая проводимость раствора электролита, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и находящимися на расстоянии 1 м друг от друга.
Электропроводность растворов электролитов зависит в первую очередь от природы электролита и растворителя и является функцией следующих факторов:
концентрации ионов;
скорости их движения, которая зависит от заряда и радиусов сольватированных ионов;
вязкости и диэлектрической постоянной растворителя;
температуры.
Удельная электрическая проводимость раствора электролита определяется количеством ионов, переносящих электричество, и скоростью их миграции.
Зависимость удельной электрической проводимости растворов некоторых электролитов от концентрации представлена на рис.1.
В разбавленных растворах сильных и слабых электролитов рост электрической проводимости с концентрацией обусловлен увеличением числа ионов, переносящих электричество. В области концентрированных растворов повышение концентрации сопровождается увеличением вязкости растворов, что снижает скорость движения ионов и электрическую проводимость.
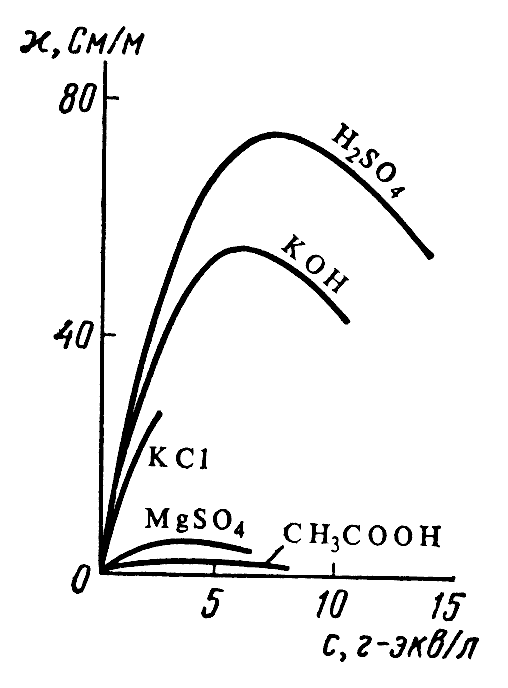 Рис.1. Зависимость удельной электрической
проводимости растворов различных
электролитов от концентрации: KCl,
KOH, H2SO4
-сильные электролиты, CH3COOH,
MgSO4– слабые
электролиты.
Рис.1. Зависимость удельной электрической
проводимости растворов различных
электролитов от концентрации: KCl,
KOH, H2SO4
-сильные электролиты, CH3COOH,
MgSO4– слабые
электролиты.
При повышении температуры электролита возрастают скорость движения ионов и удельная электрическая проводимость:
æ2= æ1 [1+b(Т2 – Т1)], (2.3)
где b - температурный коэффициент электрической проводимости (для сильных кислот – 0,016, для сильных оснований – 0,019 и для солей – 0,022).
