
- •Н. А. Колпакова, с. В. Романенко, в. А. Колпаков Физическая химия Часть ιι
- •Глава 1. Термодинамика растворов электролитов
- •1.1. Основные понятия
- •1.2. Средняя ионная активность и средний коэффициент активности
- •1.3. Зависимость коэффициента активности от ионной силы раствора
- •Глава 2. Неравновесные явления в электролитах
- •2.1. Электропроводность растворов электролитов
- •2.1.1. Удельная электрическая проводимость растворов электролитов
- •2.1.2. Молярная электрическая проводимость растворов электролитов
- •2.1.3. Кондуктометрия
- •2.1.4. Примеры решения задач
- •2.1.5. Вопросы для самоконтроля
- •2.2. Электролиз. Числа переноса
- •2.2.1.Примеры решения задач
- •2.2.2. Вопросы для самоконтроля
- •Глава 3. Равновесные электродные процессы. Электродные потенциалы и эдс гальванических элементов. Потенциометрия
- •3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
- •3.2. Потенциалы электродов. Классификация электродов
- •3.2.1. Электроды нулевого рода (окислительно-восстановительные электроды)
- •3.2.2. Электроды первого рода
- •3.2.3. Электроды второго рода
- •3.2.4.Газовые электроды
- •3.3. Гальванические элементы и их эдс
- •3.3.1 Химические цепи
- •3.3.2. Примеры решения задач
- •3.3.2. Вопросы для самоконтроля
- •3.3.3. Концентрационные цепи
- •3.3.3.Примеры решения задач
- •3.3.4. Вопросы для самоконтроля
- •3.4. Экспериментальное определение эдс
- •3.5. Термодинамика обратимых электрохимических систем
- •3.5.1. Потенциометрия
- •3.5.2. Примеры решения задач
- •3.5.3. Вопросы для самоконтроля
- •Глава 4. Химическая кинетика
- •4.1. Основные понятия химической кинетики
- •4.2. Скорость химической реакции
- •4.2.1. Скорость химических реакций в закрытых системах
- •4.2.2. Скорость химических реакций в открытых системах
- •4.2.3. Факторы, влияющие на скорость реакции
- •4.3. Основной постулат химической кинетики. Закон действующих масс
- •Вопросы и задания для самоконтроля
- •4.4. Формальная кинетика
- •4.4.1. Формальная кинетика элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •4.4.1.2. Кинетика односторонних химических реакций второго порядка
- •4.4.1.3. Кинетика односторонних химических реакций третьего порядка
- •4.4.1.4. Кинетика односторонних химических реакций нулевого порядка
- •4.4.1.5.Примеры решения задач
- •4.4.2. Методы определения порядка реакций
- •4.4.2.1. Метод избыточных концентраций
- •4.4.2.2. Дифференциальные методы определения порядка реакции
- •1). Графический метод решения.
- •2). Аналитический метод решения.
- •3) Метод начальных скоростей Вант–Гоффа.
- •2). Графический метод решения.
- •4.4.2.3. Интегральные методы определения порядка реакции
- •1)Аналитический метод решения.
- •2) Графический метод решения
- •1). Аналитический метод решения.
- •2. Графический метод решения
- •4.5. Зависимость константы скорости реакции от температуры
- •4.5.1. Примеры решения задач
- •Вопросы и задания для самоконтроля.
- •4.6. Кинетика сложных реакций
- •4.6.1 Кинетика двусторонних (обратимых) химических реакций
- •4.6.2. Кинетика параллельных химических реакций
- •4.6.3. Кинетика последовательных химических реакций
- •4.6.4. Стационарное и квазистационарное протекание реакций
- •4.7. Кинетика химических реакций в открытых системах
- •4.7.1. Кинетика химических реакций в реакторе идеального смешения
- •4.7.2. Кинетика химических реакций в реакторе идеального вытеснения
- •4.8. Кинетика цепных реакций
- •4.8.1. Кинетика неразветвленных цепных реакций
- •4.8.2. Кинетика цепных реакций с разветвленными цепями
- •4.8.3. Примеры решения задач.
- •4.9. Кинетика фотохимических реакций
- •4.9.1. Примеры решения задач
- •4.10. Теории химической кинетики
- •4.10.1. Теория активных столкновений
- •4.10.2. Теория активированного комплекса
- •4.10.2.1 Термодинамический аспект теории активированного комплекса.
- •5.2.2. Примеры решения задач.
- •2 См3/(моль·с).
- •Глава 5. Катализ
- •5.1. Основные понятия и особенности катализа
- •Вопросы для самоконтроля
- •5.2. Классификация каталитических процессов
- •5.3. Свойства катализаторов.
- •3. Соотношения линейности Бренстеда-Поляни в катализе
- •Вопросы для самоконтроля
- •5.4 Механизмы гомогенных каталитических реакций
- •Вопросы для самоконтроля
- •5.5. Примеры гомогенных каталитических реакций
- •5.5.1. Кислотно-основной катализ
- •5.5.1.1. Кинетика кислотного катализа.
- •5.5.1.2. Кинетика основного катализа
- •5.5.1.3. Примеры решения задач
- •5.5.2 Катализ комплексными соединениями
- •Вопросы для самоконтроля
- •5.5.3. Ферментативный катализ
- •5.5.3.1. Кинетика ферментативных реакций
- •5.5.3.2. Влияние ингибиторов на кинетику ферментативных реакций
- •5.5.3.3. Примеры решения задач.
- •Вопросы для самоконтроля
- •5.6. Гетерогенный катализ
- •5.6.1. Свойства гетерогенных катализаторов
- •5.6.2. Приемы повышения каталитической активности катализаторов
- •5.5.2.1. Использование в катализе носителей
- •5.6.2.2. Использование в катализе промоторов
- •5.6.2.3. Каталитические яды
- •5.6.2.4. Смешанные катализаторы
- •5.6.3. Основные стадии гетерогенно-каталитических реакций
- •5.6.4. Порядки гетерогенно-каталитических реакций
- •5.6.5. Решение кинетических задач для гетерогенно-каталитических процессов
- •5.6.5.1. Примеры решения задач
- •5.6.6. Теории гетерогенного катализа
- •Содержание
- •Глава 5. Катализ 141
- •Физическая химиЯ Часть ιι
3.5.2. Примеры решения задач
Пример 1. Вычислить термодинамические параметры (DG° , DA°, DS°, DH°, DU°) химической реакции
Cd + Hg2SO4= 2 Hg + CdSO4,
осуществляемой при работе нормального элемента Вестона. Зависимость ЭДС этого элемента от температуры выражается уравнением:
![]() .
.
Решение. Нормальный элемент Вестона представляет собой электрохимический элемент
(-) Сd(Hg), CdSO4·8/3 H2O½CdSO4aq нас. ½Hg2SO4, Hg (+)
Покажем, что итогом работы этого элемента является химическая реакция, записанная в условии задачи.
Реакции, протекающие на электродах:
а) на отрицательном Cd = Cd2+ + 2e;
б) на положительном Hg2SO4 + 2e = 2Hg + SO42-.
Cуммарная реакция, протекающая в гальваническом элементе:
Сd + Hg2SO4 = Cd2+ + 2Hg + SO42-.
Как видно, эта реакция идентична изучаемой.
Значение DG° находим по формуле (3.56), учитывая, что z = 2 (число электронов, принимающих участие в реакциях) и Т=298 К:
DG° = – 2×96485×(1,0183 – 3,8×10-5×5 – 6,5.10-7×52) = – 196497,5 Дж .
DG° = – 196,5 кДж.
Отрицательное значение энергии Гиббса указывает на то, что, при постоянном давлении и температуре, при работе нормального элемента Вестона процесс протекает самопроизвольно.
Для вычисления энергии Гельмгольца DА° используем выражение (3.57). Поскольку в электрохимической реакции, протекающей в элементе, газообразные вещества не участвуют, то Dn=0. Следовательно,
DA° = DG° = – 196,5 кДж.
Чтобы оценить значения DS° и DH°, необходимо определить температурный коэффициент ЭДС электрохимического элемента. Для этого продифференцируем по температуре уравнение зависимости Е от Т:
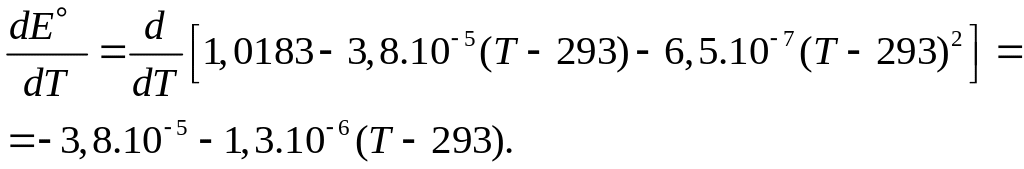
Таким образом, значение температурного коэффициента ЭДС при 298 К равно:
![]() В/К.
В/К.
Изменение энтропии в ходе реакции определяем по формуле (3.59)
![]() Дж/К.
Дж/К.
Тепловой эффект данной химической реакции с учетом формулы (3.62) равен:
 Дж;
Дж;
![]() =
–199,06 кДж.
=
–199,06 кДж.
Полученный результат показывает, что реакция в электрохимическом элементе протекает с выделением тепла.
Изменение внутренней энергии определяется по формуле (3.61). Поскольку среди компонентов электрохимической реакции, протекающей в элементе, нет газообразных веществ (Dn=0), следовательно
![]() кДж.
кДж.
Пример 2. Гальванический элемент
(–) Hg, Hg2Cl2
½ KCl
aq. ║
MnO![]() ,
Mn2+, H+
½ Pt
(+) ;
,
Mn2+, H+
½ Pt
(+) ;
использован для определения рН раствора. Если активность ионов MnO и Mn2+ равны 0,1 М и 0,01 М соответственно, то ЭДС этого элемента равна 1,07 В. Стандартный потенциал электрода MnO , Mn2+, H+½Pt равен 1,52 В. Потенциал каломельного электрода (CKCl=1моль/л), использованного в работе, равен 0,28 В. Необходимо определить рН раствора, содержащего ионы марганца.
Решение. Запишем электродную реакцию и потенциал положительного электрода:
MnO + 8 H+ + 5e ® Mn2+ + 4 H2O;
 ;
;

ЭДС элемента равна разности потенциалов положительного и отрицательного электродов:

Откуда рН раствора равно:
 ;
;
![]() .
.
Пример 3. ЭДС элемента при 298 К равна 0,72 В. Средний коэффициент активности KI в 1 М растворе равен 0,65, а средний коэффициент активности AgNO3 в 0,001 М растворе равен 0,98. Каково произведение растворимости соли AgI? Какова растворимость соли AgI в чистой воде?
Решение. Составляем гальванический элемент
(–) Ag, AgI½KI aq. ║ AgNO3 aq. ½ Ag (+)
c' = 1 M; c"=0,001 M.
Этот элемент можно рассматривать как концентрационный по отношению к ионам серебра в каждом из растворов.
По ЭДС этого элемента можно вычислить произведение растворимости малорастворимой соли:
![]() ,
,
где
![]() ;
;
![]() ,
,
тогда:
![]() .
.
Откуда Lp = 4,03.10-16.
Растворимость соли AgI определяется концентрацией ионов серебра при растворении данной соли в дистиллированной воде и рассчитывается по соотношению:
![]() M.
M.
Пример 4. Рассчитать средний коэффициент активности электролита ZnCl2, ели стандартная ЭДС элемента
Znç ZnCl2aqçAgCl,Ag
равна 0,982 В. ЭДС этого элемента при изменении концентрации электролита ZnCl2 изменялась следующим образом:
c |
моль/л |
0,00294 |
0,00781 |
0,0123 |
0,0204 |
0,221 |
Е |
В |
1,198 |
1,165 |
1,149 |
1,131 |
1,055 |
Решение. В рассматриваемом элементе отрицательный электрод (цинковый) обратим относительно катиона, а положительный (хлорсеребрянный) – обратим относительно аниона. ЭДС элемента, составленного из электрода первого рода и электрода второго рода, равна:
![]() .
.
Используя понятие средней активности ионов электролита, объединим под один логарифм активности ионов ZnCl2:
![]() ;
;
![]() .
.
Откуда:
![]() .
.
Значение логарифма среднего коэффициента активности ионов ZnCl2 равно:
 .
.
Значения средних коэффициентов активности ионов ZnCl2 при разных концентрациях электролита равны:
c |
моль/л |
0,00294 |
0,00781 |
0,0123 |
0,0204 |
0,221 |
f± |
|
0,770 |
0,695 |
0,630 |
0,61 |
0,41 |
Как видно из полученных данных, с ростом концентрации электролита средний коэффициент активности уменьшается.
