
- •Н. А. Колпакова, с. В. Романенко, в. А. Колпаков Физическая химия Часть ιι
- •Глава 1. Термодинамика растворов электролитов
- •1.1. Основные понятия
- •1.2. Средняя ионная активность и средний коэффициент активности
- •1.3. Зависимость коэффициента активности от ионной силы раствора
- •Глава 2. Неравновесные явления в электролитах
- •2.1. Электропроводность растворов электролитов
- •2.1.1. Удельная электрическая проводимость растворов электролитов
- •2.1.2. Молярная электрическая проводимость растворов электролитов
- •2.1.3. Кондуктометрия
- •2.1.4. Примеры решения задач
- •2.1.5. Вопросы для самоконтроля
- •2.2. Электролиз. Числа переноса
- •2.2.1.Примеры решения задач
- •2.2.2. Вопросы для самоконтроля
- •Глава 3. Равновесные электродные процессы. Электродные потенциалы и эдс гальванических элементов. Потенциометрия
- •3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
- •3.2. Потенциалы электродов. Классификация электродов
- •3.2.1. Электроды нулевого рода (окислительно-восстановительные электроды)
- •3.2.2. Электроды первого рода
- •3.2.3. Электроды второго рода
- •3.2.4.Газовые электроды
- •3.3. Гальванические элементы и их эдс
- •3.3.1 Химические цепи
- •3.3.2. Примеры решения задач
- •3.3.2. Вопросы для самоконтроля
- •3.3.3. Концентрационные цепи
- •3.3.3.Примеры решения задач
- •3.3.4. Вопросы для самоконтроля
- •3.4. Экспериментальное определение эдс
- •3.5. Термодинамика обратимых электрохимических систем
- •3.5.1. Потенциометрия
- •3.5.2. Примеры решения задач
- •3.5.3. Вопросы для самоконтроля
- •Глава 4. Химическая кинетика
- •4.1. Основные понятия химической кинетики
- •4.2. Скорость химической реакции
- •4.2.1. Скорость химических реакций в закрытых системах
- •4.2.2. Скорость химических реакций в открытых системах
- •4.2.3. Факторы, влияющие на скорость реакции
- •4.3. Основной постулат химической кинетики. Закон действующих масс
- •Вопросы и задания для самоконтроля
- •4.4. Формальная кинетика
- •4.4.1. Формальная кинетика элементарных и формально простых гомогенных односторонних реакций в закрытых системах
- •4.4.1.2. Кинетика односторонних химических реакций второго порядка
- •4.4.1.3. Кинетика односторонних химических реакций третьего порядка
- •4.4.1.4. Кинетика односторонних химических реакций нулевого порядка
- •4.4.1.5.Примеры решения задач
- •4.4.2. Методы определения порядка реакций
- •4.4.2.1. Метод избыточных концентраций
- •4.4.2.2. Дифференциальные методы определения порядка реакции
- •1). Графический метод решения.
- •2). Аналитический метод решения.
- •3) Метод начальных скоростей Вант–Гоффа.
- •2). Графический метод решения.
- •4.4.2.3. Интегральные методы определения порядка реакции
- •1)Аналитический метод решения.
- •2) Графический метод решения
- •1). Аналитический метод решения.
- •2. Графический метод решения
- •4.5. Зависимость константы скорости реакции от температуры
- •4.5.1. Примеры решения задач
- •Вопросы и задания для самоконтроля.
- •4.6. Кинетика сложных реакций
- •4.6.1 Кинетика двусторонних (обратимых) химических реакций
- •4.6.2. Кинетика параллельных химических реакций
- •4.6.3. Кинетика последовательных химических реакций
- •4.6.4. Стационарное и квазистационарное протекание реакций
- •4.7. Кинетика химических реакций в открытых системах
- •4.7.1. Кинетика химических реакций в реакторе идеального смешения
- •4.7.2. Кинетика химических реакций в реакторе идеального вытеснения
- •4.8. Кинетика цепных реакций
- •4.8.1. Кинетика неразветвленных цепных реакций
- •4.8.2. Кинетика цепных реакций с разветвленными цепями
- •4.8.3. Примеры решения задач.
- •4.9. Кинетика фотохимических реакций
- •4.9.1. Примеры решения задач
- •4.10. Теории химической кинетики
- •4.10.1. Теория активных столкновений
- •4.10.2. Теория активированного комплекса
- •4.10.2.1 Термодинамический аспект теории активированного комплекса.
- •5.2.2. Примеры решения задач.
- •2 См3/(моль·с).
- •Глава 5. Катализ
- •5.1. Основные понятия и особенности катализа
- •Вопросы для самоконтроля
- •5.2. Классификация каталитических процессов
- •5.3. Свойства катализаторов.
- •3. Соотношения линейности Бренстеда-Поляни в катализе
- •Вопросы для самоконтроля
- •5.4 Механизмы гомогенных каталитических реакций
- •Вопросы для самоконтроля
- •5.5. Примеры гомогенных каталитических реакций
- •5.5.1. Кислотно-основной катализ
- •5.5.1.1. Кинетика кислотного катализа.
- •5.5.1.2. Кинетика основного катализа
- •5.5.1.3. Примеры решения задач
- •5.5.2 Катализ комплексными соединениями
- •Вопросы для самоконтроля
- •5.5.3. Ферментативный катализ
- •5.5.3.1. Кинетика ферментативных реакций
- •5.5.3.2. Влияние ингибиторов на кинетику ферментативных реакций
- •5.5.3.3. Примеры решения задач.
- •Вопросы для самоконтроля
- •5.6. Гетерогенный катализ
- •5.6.1. Свойства гетерогенных катализаторов
- •5.6.2. Приемы повышения каталитической активности катализаторов
- •5.5.2.1. Использование в катализе носителей
- •5.6.2.2. Использование в катализе промоторов
- •5.6.2.3. Каталитические яды
- •5.6.2.4. Смешанные катализаторы
- •5.6.3. Основные стадии гетерогенно-каталитических реакций
- •5.6.4. Порядки гетерогенно-каталитических реакций
- •5.6.5. Решение кинетических задач для гетерогенно-каталитических процессов
- •5.6.5.1. Примеры решения задач
- •5.6.6. Теории гетерогенного катализа
- •Содержание
- •Глава 5. Катализ 141
- •Физическая химиЯ Часть ιι
3.3.2. Вопросы для самоконтроля
1. Дайте определение термина стандартный электродный потенциал и объясните причину возникновения разности потенциалов между каким-либо металлом и раствором одной из его солей.
2. В химическом источнике тока
Pt½Fe+2, Fe+3 ║ Ag+ ½ Ag
протекает реакция:
Fe+2(раств)+ Ag+(раств)= Fe+3(раств)+ Ag(тв).
Какое влияние (увеличение, уменьшение или отсутствие эффекта) должны оказать на напряжение источника тока следующие изменения:
а) увеличение концентрации Fe+3(раств);
б) одновременное увеличение концентрации Fe+3(раств) и Fe+2(раств) в одинаковое число раз;
в) добавление твердого серебра;
г) добавление некоторого количества NaCl в раствор, где имеются ионы серебра.
3. Как определить направление
самопроизвольного химического превращения
при протекании процессов в электрохимическом
элементе? Дайте обоснованный ответ, в
каком направлении будет протекать
самопроизвольно реакция:
![]()
4.Объясните, какой смысл имеют разделяющие знаки (½и║) в схематической записи химического источника тока:
Zn ½ZnSO4aq ║ CuSO4aq½Cu
Укажите, где в этой схеме анод, а где катод? Объясните смысл терминов анод и катод и укажите на схеме направление потока электронов во внешней цепи.
5. Что должно произойти при введении
ионов
![]() (в
виде солей) в раствор, в котором содержится
избыток разбавленной серной кислоты?
Для объяснения воспользуйтесь значениями
стандартных окислительно-восстановительных
потенциалов электродов:
(в
виде солей) в раствор, в котором содержится
избыток разбавленной серной кислоты?
Для объяснения воспользуйтесь значениями
стандартных окислительно-восстановительных
потенциалов электродов:
![]() =
0,76 В;
=
0,76 В;
![]() =1,52
В.
=1,52
В.
3.3.3. Концентрационные цепи
Гальванические элементы второго типа – концентрационные цепи представляют собой элементы, составленные из электродов, на которых протекают одинаковые химические реакции, но концентрации реагирующих веществ на электродах различны. Электрическая энергия в концентрационных элементах вырабатывается за счет выравнивания концентраций веществ.
Различают концентрационные цепи без переноса и с переносом. Концентрационными цепями без переноса называются элементы:
а) с одинаковыми электродами, но с разными концентрациями электролитов при отсутствии непосредственного соприкосновения между растворами;
б) с электродами из двух сплавов (амальгам), одинаковых по природе, но разных по концентрации, опущенными в один раствор электролита;
в) с газовыми электродами, одинаковыми по природе, но с разным давлением газа (с одним раствором электролита).
Примером концентрационной цепи без переноса может служить амальгамная концентрационная цепь:
![]()
a2 a1,
где a1 и a2 – активности кадмия в амальгаме.
На электродах этого концентрационного элемента протекают следующие электрохимические реакции:
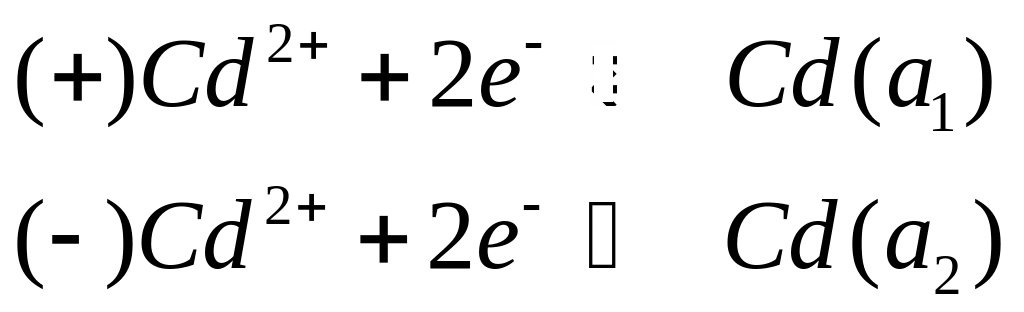 .
.
Суммарная реакция в элементе -
![]() .
.
ЭДС этого элемента вырабатывается за
счет выравнивания активности кадмия в
амальгамах (![]() ):
):
![]() . (3.37)
. (3.37)
Концентрационными цепями с переносом
называются такие концентрационные
элементы, в которых имеется непосредственная
граница соприкосновения между растворами.
На границе между растворами двух
одинаковых электролитов разной
концентрации, в результате разной
подвижности катионов и анионов, возникает
так называемый диффузионный потенциал
![]()
Например,
D
Cu | CuSO4 ¦ CuSO4 | Cu
![]() >
>
![]()
где
![]() и
и
![]() — различные активности ионов меди на
электродах, D
— диффузионный потенциал, возникающий
на границе растворов.
— различные активности ионов меди на
электродах, D
— диффузионный потенциал, возникающий
на границе растворов.
Запишем потенциалы обоих электродов:
![]() ,
,
![]() .
(3.38)
.
(3.38)
Тогда ЭДС элемента будет
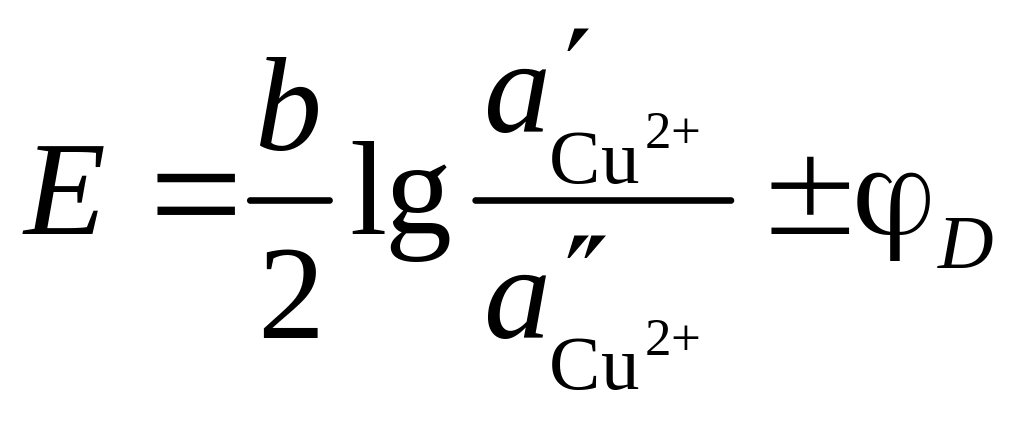 . (3.39)
. (3.39)
Как правило, различие в концентрациях веществ на разных электродах концентрационных элементов мало, поэтому диффузионный потенциал вносит существенный вклад в общую ЭДС. Существует несколько соотношений для расчета ЭДС гальванического элемента с учетом диффузионного потенциала.
1. Если электроды обратимы относительно катиона, то ЭДС гальванического элемента будет равна:
![]() , (3.40)
, (3.40)
где t– –число переноса анионов, n – общее число формульных частиц, составляющих данный электролит (общее число ионов, на которые распадается электролит ), n+ — число формульных частиц катионов(число катионов, на которые диссоциирует электролит), составляющих данный электролит.
Диффузионный потенциал рассчитывается в этом случае по соотношению:
![]() .
(3.41)
.
(3.41)
Примером концентрационного гальванического элемента обратимого относительно катиона будет, например, элемент:
D
Zn | ZnSO4 ¦ ZnSO4 | Zn
>
2. Если электроды обратимы относительно аниона, то ЭДС гальванического элемента будет равна:
![]() , (3.42)
, (3.42)
где t+ – число переноса катионов, n– – число формульных частиц анионов, составляющих данный электролит.
Диффузионный потенциал рассчитывается в этом случае по соотношению:
![]() . (3.43)
. (3.43)
Примером концентрационного гальванического элемента обратимого относительно аниона будет, например, элемент:
D
Ag | AgCl | HCl(aq) | NaCl(aq) | AgCl | Ag
>
3. Так как причиной возникновения
диффузионного потенциала является
различная подвижность ионов, то он
возникает даже на границе двух различных
растворов одинаковой концентрации. В
этом случае для различных бинарных
электролитов![]() можно рассчитать по уравнению
можно рассчитать по уравнению
D =
![]()
![]() –;
–; ![]() , (3.44)
, (3.44)
где
![]() +
и
–
– подвижности ионов электролита;
+
и
–
– подвижности ионов электролита;
![]() >
>![]() .
.
Диффузионный потенциал может быть величиной как положительной, так и отрицательной:
![]() , (3.45)
, (3.45)
где - разность потенциалов между электродами элемента, без учета .
Выбор знака “+” или “–” перед диффузионным потенциалом зависит от взаимного направления электрических полей между электродами элемента и на границе двух растворов. Если направления обоих электрических полей совпадают (см. пример), то диффузионный потенциал (абсолютная величина) прибавляется к , а если направления обоих полей не совпадают, то вычитается. Например,
D
(–) Ag|AgNO3(aq)–½+AgNO3
(aq)| Ag
(+) (![]() >
>
![]() )
)
![]()
![]()
![]()
![]() ;
;
![]() .
.
