
- •Раздел I введение
- •Глава 1
- •Раздел I. Введение
- •Глава 1. Передача информации и структурная организация мозга
- •§ 1. Строение сетчатки
- •Раздел I. Введение
- •Глава 1. Передача информации и структурная организация мозга
- •Раздел I. Введение
- •§ 2. Сигналы нервных клеток
- •Глава 1. Передача информации и структурная организация мозга
- •Раздел I. Введение
- •Глава 1. Передача информации и структурная организация мозга
- •Раздел I. Введение
- •Глава 1. Передача информации и структурная организация мозга
- •Раздел I. Введение
- •Глава 1. Передача инфармации и структурная организация мозга
- •Раздел I. Введение
- •Глава 1. Передача информации и структурная организация мозга
- •Раздел I. Введение
- •Глава 1. Передача информации и структурная организация мозга
- •§ 3. Клеточная и молекулярная биология нейронов
- •Раздел I. Введение
- •§4. Регуляция развития нервной системы
- •Глава 1. Передача информации и структурная организация мозга
- •§ 5. Регенерация нервной системы после травмы
- •Раздел II передача информации в нервной системе
- •Глава 2 Ионные каналы и нейрональная сигнализация
- •Глава 2. Ионные каналы и нейрональная сигнализация
- •§ 1. Свойства ионных каналов Клеточная мембрана нервной клетки
- •Глава 2. Ионные каналы и нейрональная сигнализация
- •§ 2. Измерение токов одиночного канала
- •Глава 2. Ионные каналы и нейрональная сигнализация
- •Глава 2. Ионные каналы и нейрональная сигнализация
- •Раздел II. Передача информации в нервной системе
- •Глава 2. Ионные каналы и нейранальная сигнализация
- •Раздел II. Передача информации в нервной системе
- •Глава 2. Ионные каналы и нейрональная сигнализация
- •Раздел II. Передача информации в нервной системе
- •Глава 2. Ионные каналы и нейрональная сигнализация
- •48 Раздел II. Передача информации в нервной системе Рекомендуемая литература
- •Цитированная литература
§ 2. Измерение токов одиночного канала
Пэтч-кламп метод
Для измерения ионных токов через одиночные каналы первоначально был предложен непрямой метод анализа мембранного шума2-3*. Затем был разработан способ прямой регистрации одиночных ионных каналов с помощью метода, который называется пэтч-кламп (patch-clamp4- 5>). В совокупности эти подходы дали прямые ответы на вопросы, касающиеся функции ионных каналов, как то:
какой заряд проходит через одиночный канал? как долго канал остается открытым? как время нахождения ионного канала в открытом или закрытом состоянии зависит от мембранного потенциала?
Пэтч-кламп метод, предложенный Э. Неером, Б. Сакманном и их коллегами, значительно углубил наши знания о функционировании ионных каналов. Для пэтч-кламп регистрации необходимо, чтобы кончик стеклянной пипетки с внутренним диаметром около 1 мкм плотно контактировал с мембраной исследуемой клетки. При удачном подведении, благодаря легкому присасыванию, между клеточной мембраной и стеклом пипетки (рис. 2.3А—В) создается сопротивление больше 109 Ом (отсюда возник термин «гигаомный контакт», gigaohm seal). Когда пипетка соединена с соответствующим усилителем, можно зарегистрировать небольшие токи, проходящие через участок мембраны, находящейся внутри кончика пипетки (рис. 2.3F). Такая конфигурация пэтч-кламп метода называется cell attached (контакт с клеткой). Высо-коомный контакт гарантирует, что ионные токи, проводимые этим участком клеточной мембраны, проходят преимущественно через
Глава 2. Ионные каналы и нейрональная сигнализация
39
(А)
■Electrode tip
Cell
(Cigaohra
seal) CELL
ATTACHED
\)-|/fD)'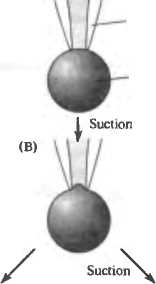
![]()

Fig. 2.3. Patch Clamp Recording. (A-E) Patch configurations, represented schematically. The electrode forms a seal on contact with the cell membrane (A), which is converted to a gi-gaohm seal by gentle suction (B) Records may then be made from the patch of membrane within the electrode tip (cell-attached patch). Pulling away from the cell results in the formation of a cell-free vesicle, whose outer membrane can then be ruptured to form an inside-out patch (C). Alternatively, the membrane within the electrode tip may be ruptured by further suction to obtain a whole-cell recording (D) or, by pulling, to obtain an outside-out patch (E). (F) Recording arrangement. The patch electrode is connected to an amplifier that converts channel currents to voltage signals. The signals are then displayed on an oscilloscope trace or computer screen so that amplitudes and durations of single-channel currents can be measured. (A-E after Hamill et aL, 1981.)
Pull (low Ca2+)
(C) INSIDE-OUT PATCH
|/(D) WHOLE-CELL f \ RECORDING
![]()
Pull
(E) OUTSIDE-OUT PATCH
Oscilloscope
усилительную аппаратуру, а не теряются в месте контакта пэтч-пипетки с клеткой. При использовании пэтч-кламп метода регистрируемые события состоят из прямоугольных токовых сигналов, отражающих процессы открытия и закрытия одиночных ионных каналов. Таким образом, мы в реальном времени можем наблюдать активность одиночных белковых молекул мембраны.
В простом случае токи одиночных каналов появляются нерегулярно и с различной продолжительностью, но с постоянной амплитудой (рис. 2.4А). В некоторых случаях, однако, картина токов может быть более сложной. Некоторые ионные каналы, например, в открытом состоянии могут иметь более чем
один уровень проводимости, как это показано на рис. 2.4В. Кроме того, ионные каналы могут проявлять комплексную кинетику. Например, ток через одиночный ионный канал может выглядеть не как простой прямоугольник, а как «вспышка» открытий канала (рис.2.4С).
Таким образом, пэтч-кламп метод предоставляет новые уникальные возможности для изучения поведения ионных каналов. Во-первых, изоляция маленького участка мембраны позволяет наблюдать активность всего нескольких ионных каналов, а не тысяч, которые активируются в целой клетке. Во-вторых, высокое сопротивление контакта дает возможность регистрировать даже крайне
40
Раздел П. Передача информации в нервной системе
![]()
![]()
[Closed (С) Open - <Р) 20 рА
40
120
160
200
![]()
![]()
![]()
4рА
(С) (О,)

 100
100
100
100 0
100

200 400 600 800 1000 1200 1400
Time (ms)
Рис. 2.4. Примеры одиночных ионных каналов, зарегистрированных методом пэтч кламп
Fig. 2.4. Examples of Patch Clamp Recordings. (A) Glutamate-activated channel currents recorded in a cell-attached patch from locust muscle occur irregularly, with a single amplitude and varied open times. Downward deflections indicate current flowing into the cell. (B) Acetylcholine-activated currents from single channels in an outside-out patch from cultured embryonic rat muscle reach a maximum amplitude of about 3 pA and relax to a substate current of about 1,5 pA. Downward deflections indicate inward current. (C) Pulses of outward current through glycine activated chloride channels in an outside-out patch from cultured chick spinal cord cells are interrupted by fast closing and reopening transitions to produce bursts. (A after Cull-Candy, Miledi, and Parker, 1980; В after Hamill and Sakmann, 1981; С from A. I. McNiven and A. R. Martin, unpublished.)
малые токи. В результате мы имеем возможность точного измерения амплитуд токов одиночных ионных каналов и можем провести анализ кинетики каналов.
Конфигурации пэтч-кламп метода
Пэтч-кламп метод позволяет осуществлять также регистрацию ионных каналов и в других конфигурациях. Достигнув контакта в конфигурации cell attached, можно, отводя электрод, оттянуть участок мембраны для формирования inside-out (внутренняя сторона наружу) конфигурации (рис. 2.3С). В последнем случае цитоплазматическая сторона мембраны будет обращена к перфузионному раствору. С другой стороны, с помощью небольшого дополнительного присасывания можно прорвать участок мембраны, расположенный внутри регистрирующего электрода, обеспе-
чив контакт последнего с цитоплазмой клетки (рис. 2.3D). В этих условиях будут регистрироваться токи в конфигурации whole-cell (целая клетка). Наконец, после получения конфигурации «целая клетка», можно оттянуть электрод от клетки, сформировав из мембраны сначала тонкую перемычку, а затем, после отделения этого участка, получить конфигурацию outside-out (наружная сторона наружу; рис. 2.3Е). Каждая из этих конфигураций имеет свои преимущества, их использование зависит от типа изучаемого ионного канала и той информации, которую мы хотим получить в данном эксперименте. Например, для аппликации веществ на внешнюю сторону мембраны предпочтительной является конфигурация outside-out.
Пэтч-кламп конфигурация «целая клетка» предполагает обмен между цитоплазмой
