
- •Пируват окисляется до уксусной кислоты
- •Суммарное уравнение окисления пировиноградной кислоты
- •Челночные системы
- •Пластическое значение катаболизма глюкозы
- •Условия проведения
- •Пентозофосфатный шунт (пфш)
- •Аэробное окисление глюкозы
- •Анаэробное окисление глюкозы
- •Этапы гликолиза
- •Энергетический баланс гликолиза
- •Общие реакции аэробного и анаэробного гликолиза
- •Реакция анаэробного гликолиза
- •Катаболизм пвк в митохондриях
- •Сахарный диабет II типа
- •Симптомы сд II типа
Сахарный диабет II типа
СД II типа представляет собой группу гетерогенных нарушений углеводного обмена. СД II типа не инсулинозависимый, не склонен к кетоацидотической коме, не имеет антител к β-клеткам, не аутоиммунной природы, не имеет связи с определенными HLA фенотипами. Ожирение в 80%. На долю СД II типа приходится примерно 85-90% всех случаев СД, он поражает людей, как правило, старше 40 лет и характеризуется высокой частотой семейных форм (риск СД II типа у ближайших родственников больного достигает 50%, тогда как при СД I типа он не превышает 10%). СД II типа поражает преимущественно жителей развитых стран, особенно горожан.
В основе СД II типа лежат множество причин. СД II типа развивается при:
генетических дефектах рецепторов инсулина, у них снижается чувствительность к инсулину;
синтезе дефектного инсулина с низкой биологической активностью (мутация гена инсулина: в позиции 24 В-цепи вместо фен присутствует лей);
нарушении превращения проинсулина в инсулин;
нарушении секреции инсулина;
повреждении инсулина и его рецепторов антителами;
повышения скорости катаболизма инсулина;
действия контринсулярных гормонов (создают гипеинсулинемию, которая вызывает инсулинорезистентность);
нарушении глюкозочувствительного механизма клеток (мутации гена глюкокиназы) и т.д.
Основным провоцирующим фактором СД II типа служит ожирение.
Симптомы сд II типа
Общие симптомы (жажда, полиурия, кожный зуд, склонность к инфекциям) выражены умеренно или отсутствуют. Часто ожирение (у 80-90% больных).
Гипогликемия снижение уровня глюкозы в крови ниже 3,3 ммоль/л. Гипогликемия бывает физиологической и патологической.
Причины физиологической гипогликемии: 1) алиментарная, при голодании; 2) длительная физическая нагрузка.
Причины патологической гипогликемии: 1) эндокринные нарушения при избытке инсулина (инсулинома – доброкачественная опухоль β-клеток, передозировка инсулина у больных СД) или недостаточности контринсулярных гормонов (гипотиреоз, дефицит глюкокортикоидов); 2) гликогенозы, агликогенозы, препятствующие гликогенолизу; 3) печеночная недостаточность, связанная с низкой активностью глюконеогенеза; 4) почечная недостаточность, связанная с врожденной патологией реабсорбции глюкозы (почечный диабет); 5) отравления монойодацетатом (вызывает глюкозурию).
Пути поступления и превращения углеводов в тканях организма
Существуют три пути превращения поступающей в организм глюкозы: 1) немедленное включение в энергетический метаболизм; 2) превращение в гликоген для долгосрочного хранения; 3) превращение в жир.
Если поступление глюкозы невелико, то большая часть ее окисляется. При достаточном поступлении часть ее немедленно превращается в гликоген и жир. Гликоген откладывается главным образом в печени (100— 250 г) и в мышцах с участием фермента гликогенсинтетазы, которая приобретает активность только в присутствии инсулина.
Окисление глюкозы происходит преимущественно в мышцах, а хранение (после трансформации ее в жир) —в жировых клетках. Следовательно, клеточные мембраны этих двух тканей находятся в постоянном контакте с глюкозой. преимущественный путь транспорта глюкозы через клеточную мембрану связан с присутствием инсулина и за висит от наличия рецепторов клеточных мембран к инсулину. В мышцах существует и другой механизм мембранного транспорта глюкозы Он действует в периоде интенсивной мышечной работы и без участия инсулина. Однако это касается весьма малой части глюкозы. Проникшая в мышечную ткань глюкоза в периоде интенсивной мышечной деятельности практически вся превращается в лактат или окисляется до С02.
Метаболизм мозга, эритроцитов, а также лейкоцитов целиком зависит от глюкозы. Эти клетки не имеют рецепторов к инсулину, и их мембраны свободно проницаемы для глюкозы. Концентрация глюкозы в нейронах и эритроцитах находится в соответствии с концентрацией ее в плазме. Следовательно, сам механизм проникновения глюкозы в нейроны, эритроциты и лейкоциты через их мембрану является простейшим передвижением субстрата по градиентам концентраций. Утилизация глюкозы в них также осуществляется без участия инсулина.
Транспортёры глюкозы
Глюкозные транспортёры - это белки, переносящие глюкозу через мембрану. Их называют белками-переносчиками, а также рецепторами глюкозы. Эти белки образуют гидрофильные трансмембранные каналы.
Глюкозные трнанспортёры делятся на две группы.
1. Na+-глюкозные ко-транспортёры (симпортёры). Эти транспортёры занимаются активным транспортом глюкозы с помощью ионов Na+ и их работа зависит от градиента концентрации натрия. Они работают только в почечных канальцах и кишечнике, обеспечивая всасывание глюкозы против градиента её концентрации.
2. Транспортные белки семейства ГЛЮТ. Они отличаются от сходных по функции белков, транспортирующих глюкозу через мембрану в кишечнике и почках, и обеспечивают облегчённую диффузию, а не активный транспорт. Белки ГЛЮТ обнаружены во всех тканях и их существует несколько разновидностей.
Все 5 типов ГЛЮТ имеют сходную первичную структуру и доменную организацию.
ГЛЮТ-1 (эритроцитарный тип) обеспечивает стабильный поток глюкозы в глиальные клетки мозга.
ГЛЮТ-2 (печёночный тип) обнаружен в клетках органов, выделяющих глюкозу в кровь. Именно при участии ГЛЮТ-2 глюкоза переходит в кровь из энтероцитов и печени. ГЛЮТ-2 участвует в транспорте глюкозы в β-клетки поджелудочной железы. В то же время ГЛЮТ-2 обеспечивает проникновение глюкозы из крови в клетки печени (гепатоциты) по механизму облегчённой диффузии. Там глюкоза превращается в активное вещество глюкозо-6-фосфат, участвующее в обмене углеводов, жиров и в энергообмене.
ГЛЮТ-3 (мозговой тип) обладает большим, чем ГЛЮТ-1, сродством к глюкозе. Он также обеспечивает постоянный приток глюкозы к клеткам нервной и других тканей.
ГЛЮТ-4 (мышечно-жировой тип) - главный переносчик глюкозы в клетки мышц и жировой ткани. Это единственный переносчик, регулируемый инсулином, поэтому мышцы и жировую ткань называют инсулинзависимыми тканями.
ГЛЮТ-5 (кишечный тип) встречается, главным образом, в клетках тонкого кишечника.
Обмен гликогена как механизм срочной регуляции уровня сахара в крови.
Резервы гликогена используются по-разному в зависимости от функциональных особенностей клетки.
Гликоген печени расщепляется при снижении концентрации глюкозы в крови, прежде всего между приемами пищи. Через 12-18 часов голодания запасы гликогена в печени полностью истощаются.
В мышцах количество гликогена снижается обычно только во время физической нагрузки – длительной и/или напряженной. Гликоген здесь используется для обеспечения глюкозой работы самих миоцитов. Таким образом, мышцы, как впрочем и остальные органы, используют гликоген только для собственных нужд.
Мобилизация (распад) гликогена или гликогенолиз активируется при недостатке свободной глюкозы в клетке, а значит и в крови (голодание, мышечная работа). При этом уровень глюкозы крови "целенаправленно" поддерживает только печень, в которой имеется глюкозо-6-фосфатаза, гидролизующая фосфатный эфир глюкозы. Образуемая в гепатоците свободная глюкоза выходит через плазматическую мембрану в кровь.
Гликогенолиз и гликогенез: реакции
Гликогенолиз - это распад гликогена , запасного полисахарида. Гликогенолиз происходит непрерывно, и за счет этого поддерживается постоянная концентрация глюкозы в крови в промежутках между приемами пищи.
Расщепление гликогена включает несколько этапов. Сначала фосфорилаза последовательно отщепляет остатки глюкозы от концов боковых цепей гликогена .При этом фосфорилируются альфа-1,4-связи и образуются молекулы глюкозо-1-фосфата. Фосфорилаза атакует боковую цепь до тех пор, пока не дойдет до точки, отстоящей на 4 остатка глюкозы от места ветвления (т. е. от альфа-1,6-связи). Затем вступает в действие система отщепления боковых цепей гликогена. Первый фермент этой системы - 4-альфа-D-глюканотрансфераза - отщепляет 3 из 4 остатков глюкозы и переносит их на свободный конец другой боковой цепи. Второй фермент - амило-1,6-глюкозидаза - отщепляет от главной цепи четвертый остаток глюкозы. После этого главная цепь гликогена становится доступной для фосфорилазы. В реакции, катализируемой амило-1,6-глюкозидазой, образуется глюкоза .

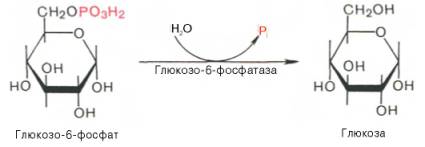
Гликогенез - биохимическая реакция протекающая в основном в печени и мышцах в результате которой глюкоза превращается в гликоген. Прежде всего глюкоза подвергается фосфорилированию при участии фермента гексокиназы, а в печени – и глюкокиназы. Далее глюкозо-6-фосфат под влиянием фермента фосфоглюкомутазы переходит в глюкозо-1-фос-фат:
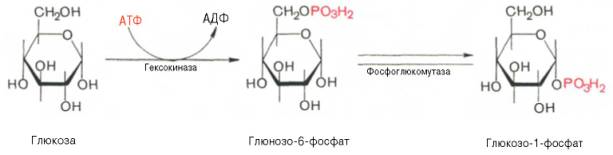
Образовавшийся глюкозо-1-фосфат уже непосредственно вовлекается в синтез гликогена. На первой стадии синтеза глюкозо-1-фосфат вступает во взаимодействие с УТФ (уридинтрифосфат), образуя уридиндифосфатглю-козу (УДФ-глюкоза) и пирофосфат. Данная реакция катализируется ферментом глюкозо-1-фосфат-уридилилтрансферазой (УДФГ-пирофосфорила-за): Глюкозо-1-фосфат + УТФ < = > УДФ-глюкоза + Пирофосфат.
На второй стадии – стадии образования гликогена – происходит перенос глюкозного остатка, входящего в состав УДФ-глюкозы, на глюкозидную цепь гликогена. Образующийся УДФ затем вновь фосфорилируется в УТФ за счет АТФ, и таким образом весь цикл превращений глюкозо-1-фосфата начинается сначала.
Взаимоотношения между ферментами синтеза и распада гликогена, механизмы их регуляции
Метаболизм гликогена в печени, мышцах и других клетках регулируется несколькими гормонами, одни из которых активируют синтез гликогена, а другие – распад гликогена. При этом в одной клетке не могут идти одновременно синтез и распад гликогена – это противоположные процессы.
Гормональная регуляция обмена гликогена осуществляется адреналином, глюкагоном и инсулином. Адрен. и глюкаг. атктивируют распад гликогена и тормозят его синтез. Гормональная регуляция опосредуется общими механизмами через цАМФ,кот.активирует цитозольные ферменты протеинкиназу,киназу фосфорилазы и киназу гликогенсинтазы. Киназы при участии АТФ фосфорилируют ферменты гликогенфосфорилазу и гликогенсинтазу. Под действием инсулина активируются ферменты фосфодиэстераза и фосфопротеинфосфатаза. Фосфодиэстераза разрушает цАМФ; фосфопротеинфосфатазы катализируют дефосфорилирование ферментов гликогенфосфорилазы и гликогенсинтазы. Фосфорилаза в дефосфорилированном состоянии становится неактивной и процесс распада гликогена прекращается, а гликогенсинтаза напротив, активируется, поэтому под действием инсулина активируется синтез гликогена.
Понятие о гликогенозах и агликогенозах.
Гликогенозы - группа наследственных заболеваний, вызванных недостаточностью одного или нескольких ферментов, вовлечённых в синтез и распад гликогена, и характеризующихся накоплением патологических количеств или типов гликогена в тканях. Симптоматика возникает вследствие накопления гликогена или его промежуточных метаболитов или из-за недостатка конечных продуктов распада гликогена, особенно глюкозы. Гликоген и некоторые из промежуточных метаболитов, депонированных в тканях, могут быть обнаружены при МРТ. Различия в степени тяжести и возрасте начала клинических проявлений вызваны вовлечением различных изоферментов или других компонентов повреждённых ферментных систем. Частота всех форм болезней накопления гликогена - 1:40 000 населения. Существует 12 типов гликогеноз.
АГЛИКОГЕНОЗЫ — наследственное заболевание, связанное с отсутствием фермента, ответственного за синтез гликогена, — (гликогенсинтетазы). При А. в печени полностью отсутствует гликоген, наблюдается полный дефицит гликогенсинтетазы при нормальной активности других ферментов, участвующих в обмене гликогена.
Клиническая картина характеризуется частыми резкими гипогликемиями (см.), содержание глюкозы в крови падает до 7—12 мг% . Гипогликемяческие судороги наиболее часты по утрам; их можно предупредить лишь частым кормлением ребенка ночью. При подозрении на А. (частые и тяжелые гипогликемии) необходима биопсия печени (исследование гликогена и ферментов). Дифференциальный диагноз проводится с гипогликемиями другой этиологии. Лечение симптоматическое. Прогноз неблагоприятный.
Химическая природа, и обмен адреналина, глюкагона и инсулина - их роль в регуляции резервирования и мобилизации гликогена и регуляции уровня глюкозы в крови.
Адреналин — катаболический гормон и влияет практически на все виды обмена веществ. Под его влиянием происходит повышение содержания глюкозы в крови и усиление тканевого обмена. Взаимодействуя с адренорецепторами, вызывает сужение мелких кровеносных сосудов, повышение артериального давления, усиление работы сердца, расслабление мускулатуры бронхов и кишечника. Адреналин стимулирует также распад триглицеридов (жиров) в тканях и усиливает катаболич. процессы. При эмоциональных переживаниях, особенно в стрессовых ситуациях, усиленной мышечной работе, охлаждении, понижении уровня сахара содержание адреналина в крови резко возрастает, что обеспечивает адаптацию организма к новым условиям.
Инсули́н — гормон пептидной природы, образуется в бета-клетках островков Лангерганса поджелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом.
Глюкагон — гормон альфа-клеток островков Лангерганса поджелудочной железы. По химическому строению глюкагон является пептидным гормоном. По биологическому действию глюкагон, как и адреналин, относятся к гипергликемическим факторам, вызывает увеличение концентрации глюкозы в крови главным образом за счет распада гликогена в печени. Органами-мишенями для глюкагона являются печень, миокард, жировая ткань, но не скелетные мышцы. Биосинтез и секреция глюкагона контролируются главным образом концентрацией глюкозы по принципу обратной связи. Таким же свойством обладают аминокислоты и свободные жирные кислоты. На секрецию глюкагона оказывают влияние также инсулин и инсулиноподобные факторы роста.
Глюконеогенез, тканевые особенности, схема, субстраты, биологическая роль. Ключевые (необратимые) реакции гликолиза и глюконеогенеза, регуляция, значение.
Глюконеогенез – синтез глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Основными субстратами глюконеогенеза являются лактат, глицерол, аминокислоты. Глюконеогенез является обратным процессом гликолиза, который протекает в цитоплазме и матриксе митохондрий. Необратимые реакции гликолиза (1, 3 и 10), катализируемые гексокиназами, фруктокиназами и пируваткиназами обходятся с участием 4 специфических ферментов глюконеогенеза: пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-фосфотазы и глюкозо-6-фосфотазы. Кроме того, в глюконеогенезе участвуют ферменты ЦТК, например, малат ДГ.
Тканевые особенности глюконеогенеза. В большинстве тканей глюконеогенеза нет.Наибольшая активность глюконеогенеза отмечается в печени, меньше в почках и слизистой оболочке кишечника, в них может синтезироваться до 80-100г глюкозы в сутки. В этих органах глюконеогенез идет до конца с образованием свободной глюкозы, которая может выходить из клеток, поддерживая гомеостаз глюкозы в крови. В норме гомеостаз глюкозы в крови обеспечивается глюконеогенезом печени до 80%, почек до 20%.
Небольшая активность глюконеогенеза наблюдается в мышечных тканях, однако из-за отсутствия у них последних ферментов глюконеогенеза, вместо свободной глюкозы образуются только ее производные, которые не способны покинуть клетку. Таким образом, углеводы синтезируются в мышечных тканях только для собственных нужд. Например, в скелетных мышцах и жировой ткани нет глюкозо-6-фосфотазы, продукт глюконеогенеза – глюкозо-6ф. В миокарде и гладких мышцах нет фруктозо-1,6-дифосфотазы, продукт глюконеогенеза – фруктозо-1,6-дф.
Биологическое
значение глюконеогенеза. Необходимость
поддержание постоянного уровня глюкозы
в крови связана с тем что, для многих
тканей глюкоза является основным
(нервная ткань), а для некоторых
единственным (эритроциты) источником
энергии. Потребность в синтезе глюкозы
объясняется тем что, гликогенолиз печени
может самостоятельно обеспечивать
гомеостаз глюкозы в крови только в
течение 8-12 часов, далее запас гликогена
в течение суток почти полностью
истощается. В условиях длительного
голодания (больше суток) глюконеогенез
является единственным источником
глюкозы в организме.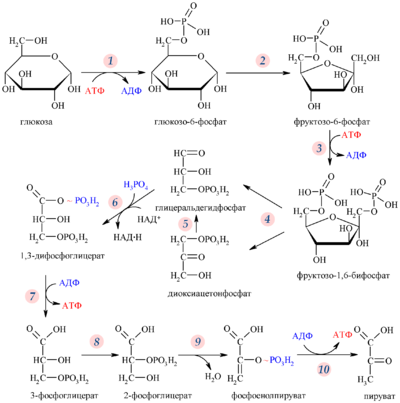
Ключевые (необратимые) реакции глюконеогенеза:
Пируваткарбоксилаза (ПВК: СО2-синтетаза (АТФ→АДФ+Фн)) содержит биотин, находиться в митохондриях, превращает ПВК в ЩУК. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин. Ингибитор: АМФ, активатор АцетилКоА. Образующийся ЩУК проходит внутреннюю мембрану митохондрий в своей восстановленной (в виде малата) или аминоформе (в виде аспартата).
Фосфоенолпируваткарбоксикиназа (ГТФ: ЩУК-2-фосфотрансфераза (декарбоксили-рующая)) находиться в цитоплазме, превращает ЩУК в ФЕП. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин.
Фруктозо-1,6-фосфотаза (Фруктозо-1,6дф: фосфо-гидролаза) дефосфорилирует фруктозо-1,6дф. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин. Ингибирует АМФ, фруктозо-2,6дф. Активатор: цитрат, жирные кислоты.
Глюкозо-6-фосфотаза (Глюкозо-6ф: фосфо-гидролаза) дефосфорилирует глюкозо-6ф. Индуктор: глюкагон, адреналин, кортизол. Репрессор: инсулин.
Регуляция глюконеогенеза. Регуляция глюконеогенеза осуществляется реципрокно с реакциями гликолиза: активация глюконеогенеза, сопровождается ингибированием гликолиза и наоборот. Регуляция обмена глюкозы происходит с участием гормонов и метаболитов, которые изменяют активность и количество регуляторных ферментов гликолиза и глюконеогенеза. Инсулин индуцирует синтез ключевых ферментов гликолиза и репрессирует синтез ключевых ферментов глюконеогенеза. Глюкагон, кортизол и адреналин индуцирует синтез ключевых ферментов глюконеогенеза. Ключевые ферменты гликолиза активируют – АМФ, фруктозо-2,6дф, фруктозо-1,6дф, ингибируют – АТФ, НАДН2, цитрат, жирные кислоты, аланин, АцетилКоА, глюкагон, адреналин. Ключевые ферменты глюконеогенеза активируют – АцетилКоА, глюкагон, ингибируют – АМФ, фруктозо-2,6дф.
Гормональная регуляция обмена углеводов
Основным показателем состояния углеводного обмена является содержание глюкозы в крови. В норме содержание глюкозы составляет 3,5 – 5,5 ммоль/л.
Снижение содержания глюкозы ниже 3,3 ммоль/л называется гипогликемия. При снижении содержания глюкозы ниже 2,7 ммоль/л развивается грозное осложнение – гипогликемическая кома. Содержание глюкозы в крови выше 6 ммоль/л называется гипергликемией. Если содержание глюкозы превышает 50 ммоль/л, развивается гипергликемическая кома. При увеличении содержания глюкозы в крови выше 10 ммоль/л глюкоза появляется в моче и возникает глюкозурия.
Инсулин – единственный гормон гипогликемического действия (снижает уровень глюкозы).
Адреналин, клюкагон, АКТГ, СТГ, глюкокортикоиды – гипергликемические гормоны(повышают уровень глюкозы).
Механизм действия инсулина
1. Повышает проницаемость клеточных мембран для глюкозы, способствуя переходу ее из крови в ткани;
2. задерживает глюкозу в клетках, активируя гексокиназу («гексокиназная ловушка глюкозы»);
3. Усиливает распад глюкозы в мышцах путем индукции синтеза регуляторных ферментов гликолиза – гексокиназы, фосфофруктокиназы, пируваткиназы;
4.В печени активирует гликогенсинтетазу, усиливает синтез гликогена – гликогенез.
5. Подавляет синтез ферментов глюконеогенеза, препятствует избыточному катаболизму жиров и белков и переходу их в углеводы.
Инсулин регулирует активность ферментов на генетическом уровне – является индуктором синтеза ферментов гликолиза и репрессором синтеза ферментов глюконеогенеза.
6. Инсулин активирует дегидрогеназы пентофосфатного пути.
Инсулин активирует:
1. Ферменты гликолиза: гексокиназу, фосфофруктокиназу, пируваткиназу.
2. Ферменты пентозофосфатного пути: глюкозо-6-фосфатдегидрогеназу, 6-фосфоглюконатдегидрогеназу.
3.Ферменты гликогенеза (синтез гликогена): гликогенсинтазу.
4. Ферменты ЦТК: цитратсинтазу.
Механизм действия адреналина и глюкагона
Усиливают распад гликогена в мышцах и печени, активируя фосфорилазу гликогена и переход глюкозы в кровь за счет активизации глюкозо-6-фосфотазы. Адреналин оказывает преимущественное действие на мышечные клетки, а глюкагон – на клетки печени.
Механизм действия глюкокортикоидов.
Усиливают глюкогенез за счет индукции синтеза в клетках печени ключевых ферментов глюкогенеза – фосфоенолпируват-карбоксилазы, пируваткарбоксилазы, фруктозо-1,6-дифосфотазы, глюкозо-6-фосфотазы.
