
- •Тепловое излучение и квантовая механика
- •Тепловое излучение и Квантовая механика
- •Предисловие
- •О Тепловое излучение – электромагнитное излучение, испускаемое веществом и возникающее за счет его внутренней энергии. Сновные формулы
- •Методические рекомендации по оформлению задач
- •Примеры решения задач
- •Тема 1: Тепловое излучения
- •Тема 2: Фотоэффект
- •Тема 3. Эффект Комптона
- •Примеры решения задач
- •Тема 4. Строение атома
- •Примеры решения задач
- •Тема 5. Длина волны де Бройля
- •Примеры решения задач
- •Найти: Решение
- •Тема 6. Соотношение неопределенностей Гейзенберга
- •Примеры решения задач
- •Найти: -? Решение
- •Тестовые задания
- •Содержания:
Тема 4. Строение атома
В 1911 году в лаборатории Э. Резерфорда при исследовании рассеяния альфа-частиц в веществе было открыто ядро атома.
На основании своих
исследований Резерфорд в 1911 г. предложил
ядерную (планетарную) модель строения
атома. В центре атома находится
положительно заряженное ядро, вокруг
которого движутся электроны. Размеры
атома
![]() ~
1010
м, размеры ядра
rя
~ 1015
м.
~
1010
м, размеры ядра
rя
~ 1015
м.
Ядро состоит из протонов и нейтронов. Нейтрон не имеет электрического заряда. Заряд протона равен +е, здесь е элементарный электрический заряд. В ядре находится N протонов, поэтому заряд ядра равен + Nе, где N - порядковый номер элемента в таблице химических элементов Д.И. Менделеева.
В нейтральном атоме вокруг ядра движутся N электронов.
В 1913 году Н. Бор
разработал теорию строения атома
водорода и водородоподобных атомов
(содержащих один электрон:
![]() …).
…).
Основу теории Бора составляют два постулата.
1. Существуют такие стационарные состояния атома, в которых он не излучает энергию. Стационарными являются состояния, для которых момент импульса электрона кратен постоянной Планка,
![]() ħ.
(4.1)
ħ.
(4.1)
Здесь ħ =
![]() называется постоянной Планка, как и h;
n-главное квантовое
число, которое принимает целые значения
n = 1, 2, 3,...
называется постоянной Планка, как и h;
n-главное квантовое
число, которое принимает целые значения
n = 1, 2, 3,...
2. При переходе из одного стационарного состояния в другое атом излучает или поглощает квант энергии
![]() .
.
![]()
энергии электрона,
находящегося в стационарных состояниях.
Рассмотрим теорию строения
водородоподобного атома по Бору.
энергии электрона,
находящегося в стационарных состояниях.
Рассмотрим теорию строения
водородоподобного атома по Бору.
На электрон, движущийся в атоме вокруг ядра, действует электрическая (кулоновская) сила притяжения к ядру (рис. 4.1). Запишем второй закон Ньютона для электрона в атоме
![]() .
.
Подставим кулоновскую силу притяжения электрона к ядру в атоме
![]()
и нормальное ускорение
![]() ,
,
во второй закон Ньютона, получим
 .
.
![]() .
(4.2)
.
(4.2)
Из формулы первого постулата Бора (4.1) найдем скорость электрона
![]() ,
(4.3)
,
(4.3)
подставим ее в соотношение (4.2) и учтем ε=1
![]() .
.
Получим радиус орбиты электрона
 .
(4.4)
.
(4.4)
В атоме водорода один протон Z = 1; для первой орбиты электрона n=1
![]() = 0,53
= 0,53![]() м (радиус первой боровской орбиты);
м (радиус первой боровской орбиты);
![]() =2,1
м,
=2,1
м,
![]() = 4,8
м,
…,
= 4,8
м,
…,
![]() .
.
О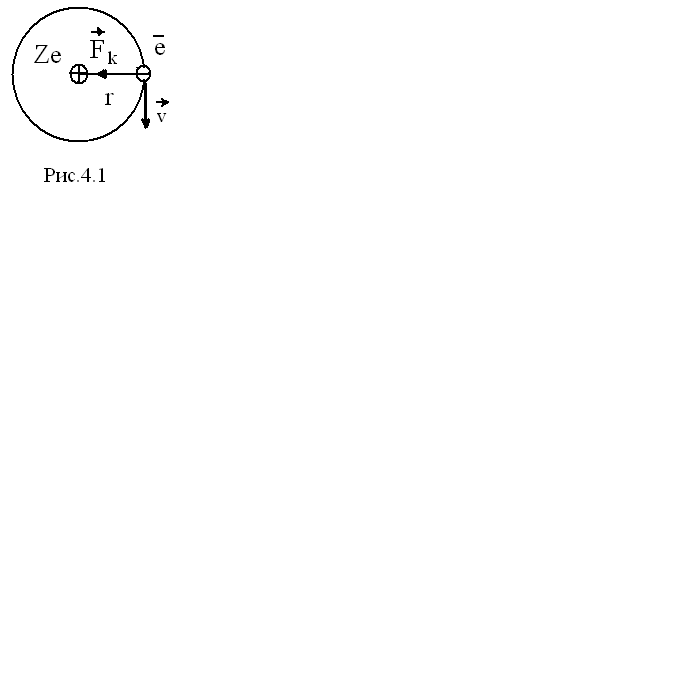 пределим
скорость электрона в атоме, подставив
в формулу (4.3) радиус орбиты электрона
(4.4),
пределим
скорость электрона в атоме, подставив
в формулу (4.3) радиус орбиты электрона
(4.4),
 ;
;
 .
.
В атоме водорода
для n
= 1 скорость электрона
![]() = 2,2
= 2,2![]() м/с.
м/с.
Полная энергия электрона в атоме равна сумме кинетической и потенциальной энергии
 .
.
Заменяя кинетическую энергию по формуле (4.2), можно записать
 ;
;
![]() .
.
Подставим в формулу радиус орбиты, получим энергию электрона в водородоподобном атоме
 .
.
В атоме водорода
энергия электрона равна:
 .
.
Энергия электрона отрицательна, т.к. он находится в атоме в связанном состоянии
 =
− 13,55 эВ;
=
− 13,55 эВ;
![]() =
− 3,39 эВ;
=
− 3,39 эВ;
![]() =
− 1,5 эВ, …,
=
− 1,5 эВ, …,
 .
.
Определим частоту излучения кванта энергии водородоподобным атомом
![]() ;
;
![]() ;
;
 .
.
Обозначим постоянную Ридберга для водорода
 .
.
после
вычислений получим значение
![]() .
.
Для частоты кванта после введения постоянной можно записать
![]() .
.
Для атома водорода
заряд ядра
![]()
 (4.5)
(4.5)
Формула (4.5) называется обобщенной формулой Бальмера.
Учитывая , получаем обобщенную формулу Бальмера для длины волны
 ,
,
где
![]() м1
также называется постоянной Ридберга,
м1
также называется постоянной Ридберга,
![]() ,
,
 .
.
Изучение спектров разреженных газов обнаружили, что у каждого газа свой линейчатый спектр, состоящий из отдельных спектральных линий. И. Бальмер подобрал формулу, расчеты, по которой совпадают с экспериментальными значениями длин волн, соответствующих спектральным линиям атома водорода в видимой области спектра
(рис. 4.2)
 ,
n
= 3, 4, 5,...
,
n
= 3, 4, 5,...
Формулу можно записать для частоты волны, учитывая ,
![]() .
.
Спектральные линии, отличающиеся значениями п, образуют группу линий, которая называется серией Бальмера.
Спектральные линии ультрафиолетовой области излучения атома водорода составляют серию Лаймана:
![]() ,
n = 2, 3, 4,…
,
n = 2, 3, 4,…
В инфракрасной области спектра водорода были открыты:
-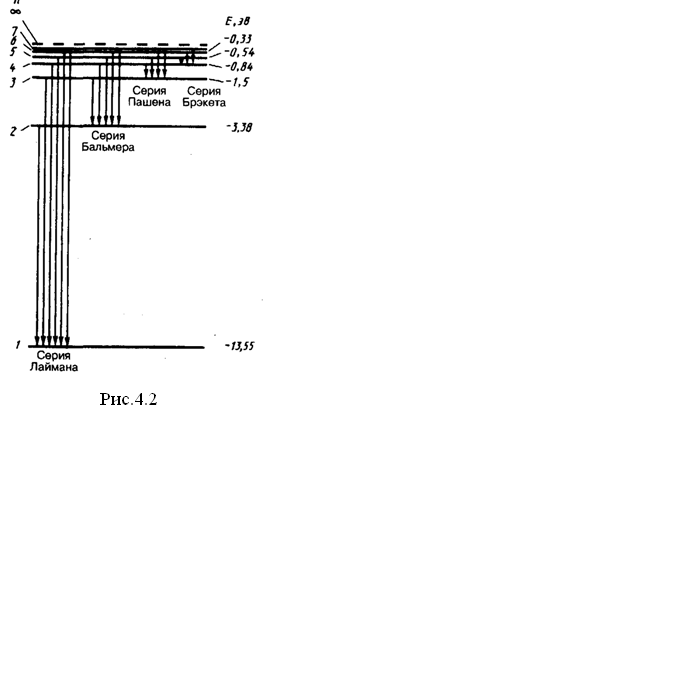 серия Пашена
серия Пашена
![]() ,
n
= 4, 5, 6…;
,
n
= 4, 5, 6…;
- серия Брэкета
![]() ,
n
= 5, 6, 7…;
,
n
= 5, 6, 7…;
- серия Пфунда
![]() ,
n
= 6, 7, 8…;
,
n
= 6, 7, 8…;
серия Хемфри
![]() ,
n
= 7, 8, 9…
,
n
= 7, 8, 9…
Все серии спектральных линий атома водорода можно представить в виде одной формулы обобщенной формулы Бальмера
,
здесь
число
![]() определяет серию и принимает значения
=
1, 2, 3, … ,а
определяет серию и принимает значения
=
1, 2, 3, … ,а
число
![]() соответствует отдельным линиям серии
и принимает целые значения от
+ 1
и
выше.
соответствует отдельным линиям серии
и принимает целые значения от
+ 1
и
выше.
Энергия излучения кванта света при переходе электрона из одного энергетического состояния в другое в атоме водорода равна
![]()
![]() .
.
При ионизации атом
теряет электрон, тогда
![]() и для энергии ионизации атома водорода
с учетом
= 1 получаем
значение
и для энергии ионизации атома водорода
с учетом
= 1 получаем
значение
![]() эВ.
эВ.
Энергия ионизации водородоподобного атома равна
![]() .
.
Энергия атома, выраженная через энергию ионизации, имеет следующий вид:
![]() .
.
Для водородоподобного атома необходимо учесть заряд ядра Z, получаем частоту излучения
 или
или
![]() .
.
