
- •Введение
- •Основы функционирования системы гемостаза
- •Преаналитический этап исследования гемостаза
- •Методы исследования тромбоцитарного гемостаза
- •Показатели индуцированной агрегации тромбоцитов (по методу Born) при различных нарушениях сосудисто-тромбоцитарного гемостаза.
- •Методы исследования коагуляционного гемостаза
Методы исследования коагуляционного гемостаза
1. Наименование исследования. Время свертывания цельной крови (ВСК) по Ли-Уайту.
Роль в физиологических процессах. Контакт крови с поврежденной сосудистой стенкой или чужеродной поверхностью, замедление и остановка кровотока (стаз) приводят к последовательной активации звеньев гемостаза: адгезии и агрегации тромбоцитов, каскадной активации плазменных белковых факторов, формированию протромбиназы, генерации тромбина и формированию фибринового сгустка, изолирующего поврежденное место и способствующего ускорению регенеративных процессов.
Характеристика теста. Оценивается время образования сгустка свежевзятой нестабилизированной венозной крови в стеклянной пробирке.
Преаналитические особенности. Специальной подготовки пациента не требуется.
Аналитические технологии, методика исследования. После обработки спиртом и высушивания области локтевого сгиба в локтевую вену вводят сухую широкую иглу без шприца. В сухую стеклянную несиликонированную пробирку набирают 1,0 мл крови, запуская секундомер сразу при ее попадании. Исследование проводят при температуре 20-25 С. Через 2 мин после взятия крови, а затем каждые 30 с, пробирку осторожно наклоняют под углом 45-60 и определяют, растекается ли кровь по стенкам. Секундомер останавливают по завершении образования сгустка (кровь не переливается при наклоне пробирки).
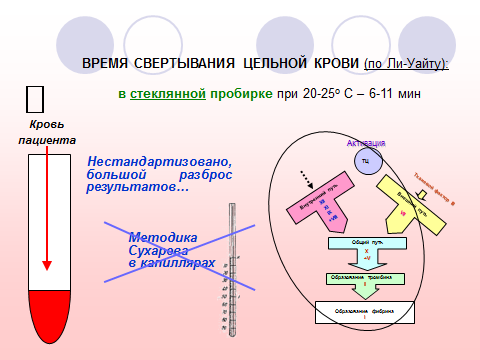
Референтные пределы. ВСК при комнатной температуре – 6-11 мин. Модификация теста ВСК по Сухареву – в стеклянных капиллярах – вследствие малой чувствительности, крайне низкой информативности и сильной посторонней интерференции исключена из перечня исследований.
Клиническое применение результатов исследования. Ввиду невысокой чувствительности тест ВСК может использоваться лишь для экспресс-диагностики грубых сдвигов гемостаза, в основном со снижением свертывающих свойств крови – дефицита плазменных факторов, избытка антикоагулянтов, ДВС крови и др.
2. Наименование исследования. Активированное частичное (парциальное) тромбопластиновое время (АЧТВ, АПТВ).
Роль аналита в физиологических процессах. При активации внутреннего пути гемостаза в результате контакта плазмы с чужеродной поверхностью или поврежденной сосудистой стенкой, на фосфолипидных матрицах (мембраны тромбоцитов и других клеток) в присутствии Ca2+ активируется сборка теназного и протромбиназного ферментных комплексов, происходит образование тромбина и формирование фибринового сгустка.
Характеристика теста. Определяется время свертывания бедной тромбоцитами цитратной плазмы при физиологической температуре (37 С), в условиях стандартной активации контактной фазы, в присутствии фосфолипидов и при добавлении ионов Ca2+. Заменителем тромбоцитарной фосфолипидной матрицы для сборки коагуляционных ферментных комплексов служат фосфолипиды мозга, эритроцитов или сои, заменителем активационной «контактной поверхности» - каолин или эллаговая кислота. Благодаря отсутствию тромбоцитов в плазме и добавлению их заменителя – парциального тромбопластина – на результаты теста АЧТВ практически не влияют тромбоцитарные факторы.
Преаналитические особенности. Соблюдают общие условия взятия венозной крови для исследования гемостаза .
Референтные пределы. 20–45 с; зависят от вида и активности реагентов, а также от типа оборудования.
Обеспечение и контроль качества. Для контроля качества чаще используется свежеразведенная референтная нормальная пулированная плазма (РНП-плазма, срок годности – 2-4 ч после разведения лиофилизированного препарата) с аттестованным значением АЧТВ.
Интерпретация результатов. Удлинение АЧТВ может свидетельствовать:
о врожденном или приобретенном снижении количества / активности факторов внутреннего пути гемостаза (XII, XI, IX, VIII, X, V, II, фибриногена), реже – фактора Виллебранда. Снижение активности факторов IX, X и II возможно, в частности, при лечении непрямыми антикоагулянтами;
об избытке в пробе цитрата – абсолютном (слишком большое количество добавленного цитрата) или относительном (неполное заполнение кровью пробирки со стандартным количеством цитрата);
о наличии в пробе гепарина (при введении пациенту или попадании из катетера) или гирудина;
о наличии в пробе некоторых инфузионных препаратов (в частности, декстранов);
о наличии в пробе продуктов деградации фибрина/фибриногена, патологических ингибиторов плазменных факторов или антикоагулянтов волчаночного типа;
Укорочение АЧТВ клинического значения не имеет, поскольку часто бывает связано с погрешностями взятия и обработки крови. Диагностика гиперкоагуляционных состояний должна основываться на определении маркеров активации гемостаза и оценке конкретной клинической ситуации.
Клиническое применение результатов исследования.
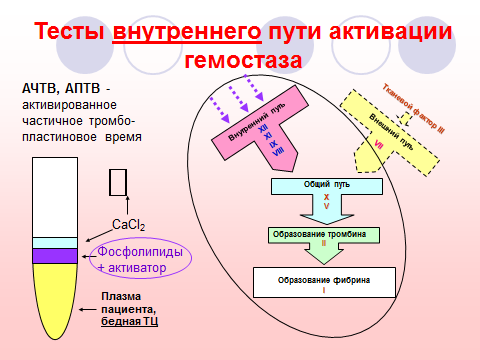
Определение АЧТВ используется для первичного выявления гипокоагуляционных сдвигов, диагностики гемофилии и мониторинга состояния больных с нарушениями свертывания крови, при ДВС крови, для контроля за гепаринотерапией, выявления патологических ингибиторов.

При диагностике антифосфолипидного синдрома для определения волчаночного антикоагулянта (антител к комплексам мембранных фосфолипидов со специфическими белками) используется т.н. люпус-чувствительный АЧТВ-реагент со сниженным содержанием фосфолипидов.
3. Наименование исследования. Протромбиновое время (ПВ).
Роль аналита в физиологических процессах. При активации внешнего пути свертывания действием тканевого фактора на плазменный фактор VII в присутствии ионов Ca2+ фактор X переходит в активную форму (Ха), формируя совместно с фактором Va протромбиназный комплекс. Образование протромбиназы приводит к генерации большого количества тромбина и формированию фибринового сгустка.
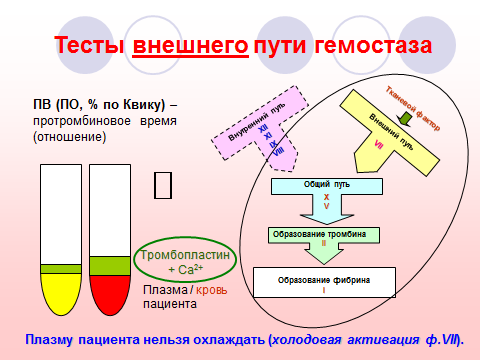
Характеристика теста. Определяется время образования фибринового сгустка в бедной тромбоцитами цитратной плазме (или цельной капиллярной крови) при активации внешнего пути гемостаза тканевым тромбопластином, содержащим тканевой фактор и фосфолипиды, в присутствии ионов Ca2+ и при физиологической температуре (37 С).
Преаналитические особенности. Соблюдают общие условия взятия венозной крови для исследования гемостаза. Оптимальным является исследование венозной крови. Капиллярная кровь менее пригодна для определения ПВ, поскольку содержит непредсказуемое количество тканевого фактора, попадающего в нее при проколе пальца, что создает определенные проблемы (в частности, в педиатрии).
Методы оценки результатов теста ПВ.
Протромбиновая активность плазмы по Квику (A.Quick, 1935 г).
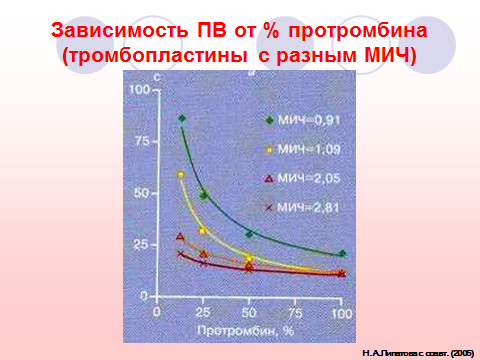
Тест основан на расчетах по калибровочному графику, отражающему зависимость активности протромбинового комплекса (то есть значения ПВ) от степени разведения нормальной плазмы, выраженной в процентах. Для построения калибровочного графика определяется ПВ неразведенной свежей нормальной пулированной плазмы (100 %) и ее 50 %, 25% и 12,5 % разведений. Некоторые исследователи считают нецелесообразным разведение 12,5% из-за снижения содержания фибриногена. Результаты откладываются на координатной сетке и соединяются линией (рис. ХХ).
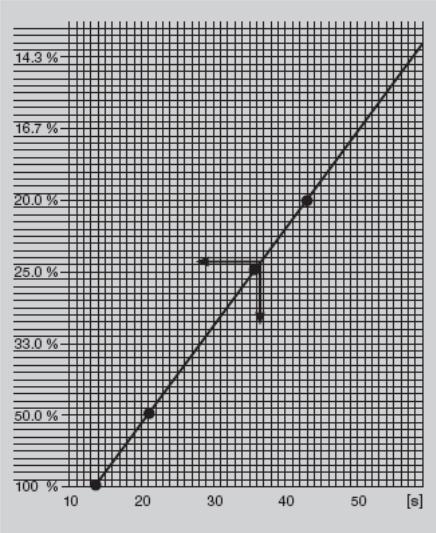
Рисунок ХХ. Пример калибровочного графика ПВ, построенного в полуобратной полулогарифмической системе координат по 4 точкам – 100 %, 50 %, 25 % и 20 % (значению 36,6 с, полученному для плазмы пациента, соответствует 24 % протромбина по Квику).
При тестировании плазмы пациента измеряется значение ПВ, и по калибровочному графику определяется «процент протромбина по Квику», отражающий активность факторов протромбинового комплекса в процентах к плазме здоровых лиц.
Расчетные показатели на основе ПВ.
Для снижения влияния интерферирующих факторов рекомендуется одновременно определять ПВ исследуемой пробы и референтной нормальной пулированной плазмы, а оценку результата проводить в виде индексов ПВ.
Протромбиновый индекс (ПИ) в % :
ПИ = (ПВ нормальной плазмы / ПВ пациента) 100 %.
Протромбиновое отношение (ПО):
ПО = ПВ пациента / ПВ нормальной плазмы.
Показатель ПО, в отличие от аналогичного ему протромбинового индекса, имеет прямую логическую связь с изменениями ПВ плазмы пациента (удлинение ПВ влечет за собой увеличение ПО). Прием антикоагулянтов непрямого действия приводит к удлинению протромбинового времени, однако измеренная степень его удлинения существенно колеблется в зависимости от используемого тромбопластинового реагента. В связи с этим Комитетом по стандартизации в гематологии ВОЗ в 1983 году был принят стандартизованный показатель – международное нормализованное отношение (MHO), который рассчитывается при контроле лечения непрямыми антикоагулянтами (когда недопустимы колебания показателей протромбинового теста в зависимости от применяемых реагентов). МНО вычисляют исходя из протромбинового отношения и международного индекса чувствительности (МИЧ) используемого тромбопластина к нехватке факторов протромбинового комплекса:
МНО = ПОМИЧ.
МИЧ для каждой серии реагента обозначается на его упаковке и обычно составляет от 1,0 до 1,6 (более низкое значение предпочтительнее).
Референтные пределы: ПВ = 10–20 с (зависит от типа реагента и условий определения). Процент протромбина по Квику = 60–130 % (зависит от препарата тромбопластина); некоторые производители указывают только нижнюю границу нормы (например, «более 70%»), подчеркивая тем самым, что укорочение ПВ и повышение процента протромбина клинического значения не имеют.
ПО = 0,85–1,2.
Обеспечение и контроль качества. В тесте Квика калибровочный график должен строиться для каждой новой серии исследований (на одни сутки) и каждой новой серии тромбопластинового реагента. Для оценки воспроизводимости и сходимости могут использоваться свежеразведенная лиофилизированная нормальная пулированная плазма (РНП-плазма), срок их годности – 2-4 ч после разведения лиофилизированного препарата.
Клиническое применение результатов исследования. Определение ПВ используется для контроля лечения антикоагулянтами непрямого действия, для выявления изменений количества и активности факторов протромбинового комплекса (VII, X, V и II) и для оценки белково-синтетической функции печени. Значительное возрастание ПВ (МНО) часто связано с риском кровотечений.
Таблица ХХ
Интерпретация результатов тестов АЧТВ и ПВ при кровоточивости у пациента (Liu MC, Kessler CM, 2002).
АЧТВ |
ПВ (ПО, МНО) |
Наиболее часто встречающаяся патология |
|
врожденная |
Приобретенная |
||
Удлинение |
Норма |
Дефицит ф.VIII, IX или XI |
Ингибитор ф.VIII |
Норма |
Удлинение |
Дефицит ф. VII |
Патология печени (дефицит ф.V и ф.VII) Гиповитаминоз K (дефицит только ф.VII) |
Удлинение |
Удлинение |
Дефицит фибриногена (<1 г/л) Дефицит протромбина, ф.V, ф.X |
ДВС крови Патология печени Приобретенная недостаточность факторов (амилоидоз) Волчаночный антикоагулянт (кровоточивости нет) |
Норма |
Норма |
Умеренная недостаточность факторов Болезнь Виллебранда (умеренной степени) Недостаточность ф.XIII |
Тромбоцитопения Качественные нарушения тромбоцитов Приобретенная болезнь Виллебранда |
4. Наименование исследования. Тромбиновое время (ТВ).
Роль аналита в физиологических процессах. Под воздействием тромбина от фибриногена отщепляются фибринопептиды А и В, и активированные молекулы фибриногена (мономеры) быстро полимеризуются, образуя сгусток фибрина.
Характеристика теста. Определяется время образования фибринового сгустка при добавлении стандартного раствора тромбина к исследуемой цитратной плазме при 37 °C.
Аналитические технологии, методика исследования. К исследуемой бедной тромбоцитами плазме при 37 °C добавляют раствор тромбина и определяют время образования фибринового сгустка (автоматически - на коагулометре, или вручную – путем покачивания пробирки в водяной бане). Параллельно тестируют нормальную плазму.
Референтные пределы: 14–17 с (зависит от активности тромбина).
Обеспечение и контроль качества. Для контроля качества используется РНП-плазма.
Клиническое применение результатов исследования. Определение ТВ – один из базовых методов исследования коагуляционных параметров плазмы. Тест проводится для выявления нарушений на этапе превращения фибриногена в фибрин, зависящем в основном от количества фибриногена и ингибиторов фибринообразования - гепарина, ПДФ и др. Значительное удлинение ТВ свидетельствует о риске развития кровотечений.
6. Наименование исследования. Фибриноген (концентрация).
Роль аналита в физиологических процессах. Фибриноген – основа для образования фибриновых сгустков – синтезируется в печени и постоянно присутствует в плазме. От его молекул под действием тромбина отщепляются фибринопептиды и образуются фибрин-мономеры, которые затем самопроизвольно полимеризуются и перекрестно «сшиваются». Сформированный фибриновый сгусток изолирует поврежденное место сосудистой стенки или чужеродные частицы.
Характеристика теста. Хронометрический метод (по A.Clauss, 1957) предполагает определение времени образования фибринового сгустка при добавлении избытка высокоактивного тромбина к разведенной в 10 раз плазме (для снижения влияния антитромбиновых компонентов) при 37 °С. В этих условиях время реакции зависит в основном от концентрации фибриногена, которая определяется по калибровочному графику.
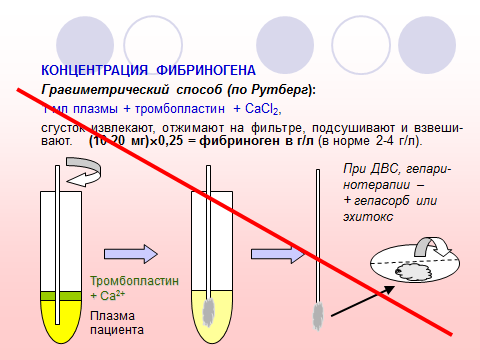
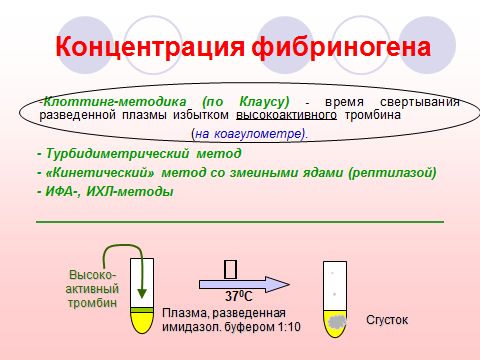
Референтные пределы. При определении хронометрическим методом 1,8–4,0 г/л (у новорожденных – 1,2–3,0 г/л).
Интерпретация результатов. Фибриноген синтезируется в печени и относится к группе белков острой фазы. Повышение его концентрации в плазме и в цельной крови возможно при любой острофазовой реакции (воспаление, инфекции, ожоги, травмы, послеоперационный период, острый инфаркт миокарда), а также при болезнях почек, системных заболеваниях соединительной ткани, злокачественных новообразованиях и др. У здоровых женщин уровень фибриногена возрастает при беременности, при введении эстрогенных препаратов и во время месячных.
Основные причины снижения содержания фибриногена – гиперпотребление при образовании большого количества микросгустков (ДВС, травмы, ожоги, шок, тяжелый токсикоз), распад в результате действия фибринолитических препаратов (стрептокиназы и т.п.), или нарушение синтеза при тяжелой патологии печени (цирроз, острая дистрофия), а также значительная гемодилюция. Необходимо учитывать, что тяжелые гнойно-воспалительные процессы, приводящие к развитию синдрома ДВС, могут способствовать повышению уровня фибриногена как острофазного белка, и тем самым маскировать его усиленное потребление.
7. Наименование исследования. Фактор V (активность / количество).
Роль аналита в физиологических процессах. Плазменный ф.V (проакцелерин) синтезируется в печени и в неактивном виде циркулирует в крови, а также содержится в тромбоцитах. После протеолитической активации ф.Vа выступает в качестве основного кофактора ф.Xа, повышая его активность на несколько порядков.
Количественное определение проводится ИФА-методом с использованием моноклональных антител к тяжелой цепи ф.V и конъюгата пероксидазы с поликлональными антителами к ф.V. Метод дает представление о количестве, но не о реактивности фактора.
Референтные пределы. 50–150 % от уровня нормальной пулированной плазмы.
Клиническое применение результатов исследования. Исследование проводится для дифференциации причин удлинения ПВ на фоне нормального АЧТВ. Минимальный гемостатический уровень активности фактора V в крови составляет 5-15 %, для выполнения операций – 25 %.
8. Наименование исследования. Антитромбин (активность/количество антитромбина III).
АТ – основной естественный ингибитор свертывания крови, первичный антикоагулянт. В присутствии гепарина АТ связывает и инактивирует тромбин и большинство других активных плазменных факторов – сериновых протеаз (ф.Ха, ф.IXa, ф.XIa, ф.XIIa, плазмин и др.), предотвращая неконтролируемую коагуляцию.
Характеристика теста. Активность АТ в исследуемой плазме определяют по его способности инактивировать вносимый извне тромбин.
Возможно количественное определение количества антитромбина (антигена) иммунохимическими методами – ИФА, ИХЛ и др.
Референтные пределы. 70–130 % от уровня нормальной плазмы.
Клиническое применение результатов исследования. Контроль активности антикоагулянтной системы плазмы в целом и АТ в частности необходим при тромбозах, тромбофилических состояниях, ДВС крови и ряде лекарственных воздействий. При выраженном снижении уровня AT значительно увеличивается риск развития тромбозов; срочная коррекция этого состояния осуществляется путем инфузии препаратов АТ или свежезамороженной плазмы.
9. Наименование исследования. Протеин C (PC, активность / количество).
Протеин C – важнейший ферментный фактор антикоагулянтной системы. Он синтезируется печенью (зависимо от витамина К) и постоянно циркулирует в крови в неактивном виде. После активации комплексом тромбин-тромбомодулин на поверхности неповрежденных эндотелиальных клеток и тромбоцитов PC в присутствии своего кофактора – протеина S – частично разрушает неферментные плазменные факторы Vа и VIIIа, тем самым сдерживая активность коагуляционных процессов.
Характеристика теста. Протеин C (PC), содержащийся в исследуемой плазме, переходит в активное состояние после добавления специфического неферментного активатора из змеиного яда.
Возможно количественное определение антигена протеина C иммунохимическими методами – твердофазным ИФА (ELISA), иммунохемилюминесцентным и др.
Референтные пределы. 70-140 % от уровня нормальной плазмы.
Клиническое применение результатов исследования. Мониторинг активности PC следует проводить при рекуррентных тромбозах, тромбоэмболиях, ДВС крови. Врожденная недостаточность PC является тромбофилическим состоянием и требует профилактических мер для предупреждения тромбозов. Снижение активности протеина С до 50 % от нормы и ниже на фоне терапии антикоагулянтами непрямого действия может приводить к развитию кожных некрозов (варфариновые некрозы), которые встречаются нечасто, но протекают тяжело. В связи с этим использование непрямых антикоагулянтов у пациентов с дефицитом PC должно проводиться с особой осторожностью под контролем активности протеина С; при необходимости – с восполнением его дефицита свежезамороженной плазмой или препаратом рекомбинантного PC.
10. Наименование исследования. Протеин S (количество / активность).
Протеин S – витамин К-зависимый неферментный кофактор протеина C – синтезируется в печени и циркулирует в кровотоке. Около 60% ПрS в плазме связано с C4b-переносящим белком, около 40% составляет свободная активная форма. При отсутствии или недостаточной концентрации ПрS активность протеина С существенно снижается, что ведет к нарушению функции антикоагулянтного звена.
Иммунохимическими методами (ELISA, RIA) определяется количество протеина S, но не его функциональная активность. Прямое определение общего ПрS (свободного + связанного) основано на использовании поликлональных антител, свободного ПрS – моноклональных антител, высокоспецифичных к эпитопам свободной формы аналита.
Референтные пределы. Общий протеин S – 65-140 % от уровня РНП-плазмы, или 0,67-1,25 ЕД/мл; свободный протеин S – 57-120 %, или 0,23-0,49 ЕД/мл.
Интерференции. На результаты ИФА-теста влияет липемия сыворотки / плазмы и присутствие ревматоидного фактора. Снижение уровня ПрS может быть связано с приемом пероральных контрацептивов.
Клиническое применение результатов исследования. Выявление снижения содержания / активности протеина S важно для выявления причин тромбофилии с эпизодами венозных тромбозов и тромбоэмболии как в молодом, так и в зрелом возрасте. Наличие дефицита протеина S может влиять на тактику ведения больных с тромбозами и использования гормональных препаратов у женщин.
11. Наименование исследования. ХПа-калликреин-зависимый фибринолиз (ХПа-зависимый лизис эуглобулинов).
Роль аналита в физиологических процессах. Активация фибринолиза протекает одновременно с запуском внутреннего пути гемостаза, поскольку инициируется одними и теми же факторами - ф.XII и компонентами калликреин-кининовой системы; фактор XII даже более значим для фибринолиза, чем для гемостатических функций. Образующийся активный плазмин постепенно разрушает фибриновые сгустки и способствует восстановлению кровотока в сосуде.
Характеристика теста. Из цитратной бедной тромбоцитами плазмы в слабокислой среде после добавления каолина выделяют эуглобулиновую фракцию, содержащую фибриноген, плазминоген и активированные факторы внутреннего пути свертывания (в т.ч. ф.XII, калликреин и плазмин). После отделения эуглобулинов, их растворения в буфере и рекальцификации образуется фибриновый сгусток, который растворяется плазмином (определяют время лизиса сгустка).
Референтные пределы. ХПа-зависимый лизис эуглобулинов – 4-12 мин
Интерференции. На результаты исследования существенно влияют концентрация фибриногена в исследуемой плазме, введение лекарственных препаратов, стимулирующих протеолитические процессы (фибринолитики), а также ингибиторов протеолиза (контрикал, трасилол и др.).
Обеспечение и контроль качества. Четкая процедура контроля в настоящее время не определена.
Клиническое применение результатов исследования. Исследование лизиса эуглобулинов проводят для оценки состояния системы фибринолиза у пациентов.
21. Наименование исследования. Плазминоген (количество / максимальная активность).
Роль аналита в физиологических процессах. Плазминоген – главный компонент фибринолитической системы – синтезируется в печени и почках и постоянно находится в крови. Образующийся из плазминогена под действием активаторов плазмин постепенно разрушает фибриновые сгустки и способствует восстановлению кровотока.
Характеристика теста. После максимальной активации стрептокиназой плазминогена в исследуемой плазме определяется скорость расщепления пептидного хромогенного субстрата (по нарастанию окраски реакционной среды, метод фиксированного времени). Количество образующегося при этом окрашенного вещества прямо пропорционально количеству активности плазминогена. Для определения количества плазминогена может использоваться и метод ИФА.
Референтные пределы. при определении ИФА-методом – около 200 мкг/мл.
Клиническое применение результатов исследования. Тест используется для оценки состояния фибринолиза и резерва плазминогена у пациентов.
12. Наименование исследования. D-димер.
Роль аналита в физиологических процессах. D-димер – продукт распада фибринового сгустка – представляет собой молекулярные фрагменты поперечно сшитого фибрина, образующиеся при его протеолитической деградации активным плазмином.В структуре D-димера имеются D-D-связи («поперечные сшивки»), которые отсутствуют в фибриногене, фибрин-мономере и рыхлом фибрин-полимере, образуются в результате действия ф.XIIIa, уплотняют фибриновый сгусток и не разрушаются плазмином. В целом для анализа D-димера предпочтительны количественные методы, позволяющие вести временной мониторинг аналита.

Референтные пределы. В количественных тестах – 110–300 нг/мл, или <0,5 мг/л; в качественных тестах D-димер у здоровых людей не выявляется.
Клиническое применение результатов исследования. В целом D-димер - один из наиболее надежных ранних маркеров тромбообразования и фибринолиза (распада фибрина, но не фибриногена) in vivo. Основная цель исследования D-димера – исключение наличия тромбов в сосудистом русле (при дифференциальной диагностике тромбоза глубоких вен нижних конечностей, тромбоэмболии легочной артерии и др.). Он может применяться как тест первой линии, то есть у всех больных с подозрением на венозный тромбоэмболизм. Кроме того, тест может использоваться в диагностике ДВС и при определении эффективности антитромботической терапии.
13. Наименование исследования. РФМК-тест (растворимые фибрин-мономерные комплексы, орто-фенантролиновая проба).
Роль аналита в физиологических процессах. Образование фибрин-мономеров (ФМ) – начальная реакция формирования сгустка; количество ФМ зависит от степени тромбинемии. В процессе физиологической активации фибринолиза продукты деградации фибрина и фибриногена образуют комплексы с фибрин-мономерами – РФМК.
Характеристика теста. Метод основан на регистрации времени появления хлопьев или зерен паракоагулята при добавлении к исследуемой бедной тромбоцитами плазме раствора о-фенантролина; при этом скорость образования хлопьев зависит от концентрации РФМК.
Референтные пределы. Хлопья не должны образовываться в первые 70-120 с наблюдения (отрицательный результат пробы, концентрация РФМК < 35-40 мг/л).
Клиническое применение результатов исследования. РФМК-тест позволяет судить об активности свертывания крови, а динамическая оценка уровня РФМК – о развитии процесса и эффективности терапевтических мероприятий. Применение тестов этой группы нецелесообразно при доступности более современных и стандартизованных методик оценки активации свертывания и фибринолиза (D-димер, фрагменты протромбина, комплекс тромбин-антитромбин, фибринопептид А, продукты деградации фибрина и фибриногена и т.д.).
14. Наименование исследования. Волчаночный антикоагулянт (ВА).
Роль
аналита в физиологических процессах.
Волчаночный антикоагулянт представляет
собой гетерогенную группу антител
против отрицательно заряженных анионных
фосфолипидов и их комплексов со
специфическими белками. Антикоагулянты
волчаночного типа связываются с
фосфолипидными мембранами и «экранируют»
их; при этом тормозится активация
коагуляционных ферментных комплексов
и замедляется свертывание крови in
vitro.

Таблица ХХ
Лабораторные тесты для оценки гемостаза
Оценочные тесты 1-го уровня – выполняются в лабораториях первичного звена: количество тромбоцитов, время кровотечения, АЧТВ, ПВ (МНО), фибриноген по Клаусу |
Оценочные тесты 2-го уровня – выполняются в лабораториях диагностических центров и стационаров: агрегация тромбоцитов, ТВ, D-димер (или РФМК), лизис эуглобулинов |
Дополнительные тесты – выполняются в специализированных лабораториях: при кровоточивости - активность фактора Виллебранда и плазменных факторов свертывания (VIII, IX, XI, VII, X, V, II, HMWK, PK) при склонности к тромбозам - АТ, протеины C и S, аРС-резистентность, гомоцистеин, волчаночный антикоагулянт, антифосфолипидные антитела, генетическое тестирование (FV Лейден G1691A, мутация гена протромбина G20210A) |
Контроль антитромботической терапии – в лабораториях всех уровней: терапия нефракционированным гепарином – АЧТВ, терапия непрямыми антикоагулянтами – МНО |
