
- •1.1 Элементы кинематики
- •1.2 Элементы динамики частиц.
- •I)в классической механике:
- •Утверждение:
- •Основная физическая интерпретация:
- •[Править]Вывод уравнений Гамильтона [править]Вывод из принципа стационарного действия
- •II)в классической статистической механике:
- •3) Уравнение Лиувилля:
- •Физическая интерпретация:
- •4)Уравне́ние Бо́льцмана
- •Формулировка:
- •III)в квантовой механике:
- •Формулировка: Общий случай:
- •Случай трёхмерного пространства:
- •Границы применимости классической механики
- •1.3 Закон сохранения импульса
- •1.4. Элементы механики твердого тела
- •1.5. Принцип относительности в механике
- •1.6. Элементы релятивистской механик
- •Первый постулат Эйнштейна: никакими физическими опытами, производимыми внутри инерциальной системы отсчета, невозможно установить, покоится эта система или движется прямолинейно и равномерно.
- •1. Сокращение длинны движущихся объектов:
- •2. Замедление движущихся часов:
- •3. Закон сложения скоростей:
- •2. Механика колебаний и волн.
- •2.1.Кинематика гармонических колебаний.
- •2.2. Гармонический осциллятор
- •2.3. Волновые процессы. Скорость движения частиц упругой среды- это частная производная от смещения по времени, т.Е.
- •3. Статистическая физика и термодинамика.
- •3.1. Элементы молекулярно-кинетической теории
- •3.2.Статистические распределения
- •3.3. Явление переноса
- •1 . Теплопроводность.
- •Коэффициент теплопроводности
- •3.4.Элементы термодинамики
- •Следствия: Недостижимость абсолютного нуля температур
- •Поведение термодинамических коэффициентов
- •Нарушения третьего начала термодинамики в моделях
- •3.5.Реальные газы, жидкости и кристаллы. Межмолекулярное взаимодействие
- •Классификация твёрдых тел
- •Классификация решёток по симметрии
Следствия: Недостижимость абсолютного нуля температур
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достигнуть ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
Поведение термодинамических коэффициентов
Из третьего начала термодинамики вытекает ряд термодинамических следствий: при должны стремиться к нулю теплоёмкости при постоянном давлении и при постоянном объёме, коэффициенты теплового расширения и некоторые аналогичные величины. Справедливость третьего начала термодинамики одно время подвергалась сомнению, но позже было выяснено, что все кажущиеся противоречия (ненулевое значение энтропии у ряда веществ при T = 0) связаны с метастабильными состояниямивещества, которые нельзя считать термодинамически равновесными.
Нарушения третьего начала термодинамики в моделях
Третье начало термодинамики часто нарушается в модельных системах. Так, при энтропия классического идеального газа стремится к минус бесконечности. Это говорит о том, что при низких температурах уравнение Менделеева — Клапейрона неадекватно описывает поведение реальных газов.
Таким образом, третье начало термодинамики указывает на недостаточность классической механики и статистики и является макроскопическим проявлением квантовых свойств реальных систем.
В квантовой механике, тем не менее, в модельных системах третье начало также может нарушаться. Таковы все случаи, когда применяется распределение Гиббса и основное состояние является вырожденным.
Несоблюдение третьего начала в модели, однако, не исключает того, что в каком-то диапазоне изменения физических величин эта модель может быть вполне адекватна.

3.5.Реальные газы, жидкости и кристаллы. Межмолекулярное взаимодействие
![]()
Рис. 1 Межмолекулярное взаимодействие

Рис. 2 Межмолекулярное взаимодействие
Межмолекулярное взаимодействие, взаимодействие между электрически нейтральными молекулами или атомами; определяет существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в разнообразных физических явлениях. М. в. зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r) (потенциалом М. в.), так как именно средняя потенциальная энергия взаимодействия определяет состояние и многие свойства вещества.
Реальные газы.
При движении молекулы вдали от стенок сосуда, в котором заключен газ, на нее действуют силы притяжения соседних молекул, но равнодействующая всех этих сил в среднем равна нулю, т.к. молекулу со всех сторон окружает в среднем одинаковое число соседей. При приближении некоторой молекулы к стенке сосуда все остальные молекулы газа оказываются по одну сторону от нее и равнодействующая всех сил притяжения оказывается направленной от стенки сосуда внутрь газа. Это приводит к тому, что уменьшается импульс, передаваемый молекулой стенке сосуда. В результате давление газа на стенки сосуда уменьшается по сравнению с тем, каким оно было бы в отсутствие сил притяжения между молекулами: p = p идеального + delta p. Вместо уравнения идеального газа получаем p + delta p = nkT ; delta p = a/V(ст.2);
Где a - постоянная, зависящая от вида газа. Для одного моля газа получаем p+a/V(ст.2) = R T / V ; Поправка: при любых давлениях, объем газа не может стать равным нулю.
Уравнение Ван-дер-Ваальса:
При увеличении плотности (давления) поведение газа все сильнее отличается от поведения идеального газа. Это объясняется тем, что при малых средних расстояниях между молекулами все большее значение приобретают силы межмолекулярного взаимодействия. На малых расстояниях эти силы являются силами отталкивания, а на больших – силами притяжения. Влияние этих сил на вид уравнения состояния можно приближенно учесть следующим образом. Для реальных газов давление должно резко возрастать при конечном объеме, равном по порядку величины объему всех частиц газа. Обозначим этот конечный объем для одного моля через b, тогда давление газа может быть записано в виде
![]() .
.
Действие сил притяжения между молекулами проявляется в уменьшении давления газа по сравнению с приведенной величиной. Уменьшение давления связано с тем, что на молекулу, находящуюся у стенки сосуда, действует сила, направленная внутрь сосуда. Она обусловлена притяжением со стороны молекул газа, находящихся в его объеме. В первом приближении ее величина пропорциональна концентрации молекул
n
=![]() ,а,
учитывая, что давление само пропорционально
концентрации, поправка на уменьшение
давления будет пропорциональна
,а,
учитывая, что давление само пропорционально
концентрации, поправка на уменьшение
давления будет пропорциональна
n2
=
![]() .
.
Учитывая это, можно прийти к соотношению
P
=
![]() ,
,
которое в форме
![]()
называется уравнением Ван-дер-Ваальса (для одного моля газа). Поправки a и b – постоянные Ван-дер-Ваальса, учитывающие соответственно действие сил притяжения и отталкивания между молекулами газа.
Переход вещества из газообразного состояния в жидкое или твердое. Конденсация возможна только при температурах ниже критической температуры.КРИТИЧЕСКАЯ ТЕМПЕРАТУРА-предельная температура равновесного сосуществования двух фаз (жидкости и ее пара), выше которой эти фазы неразличимы.КРИТИЧЕСКОЕ СОСТОЯНИЕ-состояние двух равновесно сосуществующих фаз, при достижении которого фазы становятся тождественными по своим свойствам. Критическое состояние характеризуется критическими значениями температуры, давления, удельного объема, развитием флуктуаций. В критическом состоянии системы жидкость-пар удельные объемы жидкой и паровой фаз становятся одинаковыми, теплота фазового перехода обращается в нуль, исчезают граница раздела фаз и поверхностное натяжение. Поэтому критическое состояние можно рассматривать как предельное состояние однофазной системы. Сжимаемость системы жидкость-пар в критическом состоянии очень велика, вследствие чего резко возрастают флуктуации плотности и наблюдается критическая опалесценция.
Фаза-однородная по химическому составу и физическим свойствам часть термодинамической системы, отделенная от др. частей (фаз), имеющих иные свойства, границами раздела, на которых происходит изменение свойств.
Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее-точки, относительно которых частицы совершают колебания, называются узлами кристаллической решетки
Критические параметры
Критические температура и давление. Газы могут быть превращены в жидкость сжатием при условии, что температура не превышает определенного для каждого газа значения. Температура, при которой и выше которой данный газ не может быть сжижен никаким повышением давления, называется критической Ткр. Давление, при котором и выше которого повышением температуры нельзя испарить жидкость, называется критическим ркр. Объем газа, соответствующий критической температуре, называется критическим Vкр, а состояние газа, отвечающее критической температуре, критическому давлению и критическому объему, — критическим состоянием газа.

Ближний порядок — это упорядоченность во взаимном расположении атомов или молекул в веществе, которая (в отличие от дальнего порядка) повторяется лишь на расстояниях, соизмеримых с расстояниями между атомами, то есть ближний порядок есть закономерность в расположении соседних атомов.
Ближним порядком в расположении молекул обладают, например, аморфные тела и жидкости.
Радиальная функция распределения

Радиальная
функция распределения g(r) для жидкости
Леннарда-Джонса вблизи тройной
точки (![]() ).
Результат компьютерного моделирования.
).
Результат компьютерного моделирования.
Понятие
ближнего порядка вводится через парную
функцию распределения ![]() .
Для этого f2представляется
в виде
.
Для этого f2представляется
в виде
![]()
где ![]() —
одночастичная функция распределения,
а
—
одночастичная функция распределения,
а ![]() —
расстояние между двумя молекулами.
Функция g(r) носит
название радиальной функции распределения.
В основе такого представления парной
функции распределения лежит предположение
об однородности жидкости и изотропности
потенциала взаимодействия.
—
расстояние между двумя молекулами.
Функция g(r) носит
название радиальной функции распределения.
В основе такого представления парной
функции распределения лежит предположение
об однородности жидкости и изотропности
потенциала взаимодействия.
Для идеального
газа g(r)
= 1, то есть ближний порядок отсутствует,
так как расположение каждой частицы в
пространстве не зависит от расположения
других частиц и двухчастичная функция
распределения является просто
произведением одночастичных ![]() .
.
Однако для реального вещества ситуация иная. На рисунке показана характерная радиальная функция распределения для жидкости Леннарда-Джонса вблизи тройной точки. Она имеет осцилляции, затухающие с ростом r. Таким образом, вероятность найти молекулы на расстояниях, соответствующих локальным максимумамg(r) больше, нежели на расстояниях, соответствующих локальным минимумам — в жидкости присутствует ближний порядок.
При
увеличении температуры или уменьшении
плотности ближний порядок становится
всё менее отчётливым. Для разреженного реального
газа ![]() ,
,
U(r) — потенциал парного взаимодействия частиц. Для этого случая остаётся только почти нулевая область при малых r (соответствует конечным размерам молекул) и единственный пик (соответствует минимуму U(r)).

Жи́дкость — одно из агрегатных состояний вещества. Основным свойством жидкости, отличающим её от других агрегатных состояний, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём.
Жидкое состояние обычно считают промежуточным между твёрдым телом и газом: газ не сохраняет ни объём, ни форму, а твёрдое тело сохраняет и то, и другое.
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает несохранение формы (внутренних частей жидкого тела).
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние(происходит кристаллизация либо превращение в твердотельное аморфное состояние — стекло), выше — в газообразное (происходит испарение). Границы этого интервала зависят от давления.
Фазовые переходы между агрегатными состояниями веществ. Переходы 1 и 2 рода.
Состояния веществ:
1)твердое
2)жидкое
3)газообразное
4)плазма
Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы 1 рода характеризуются постоянством температуры, изменениями энтропии и объема. Объяснение этому можно дать следующим образом. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решетки. Подводимая при плавлении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. В подобных переходах-из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние - степень беспорядка увеличивается, т. е., согласно второму началу термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет.
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами II рода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Общая трактовка фазовых переходов II рода предложена советским ученым Л. Д. Ландау (1908—1968). Согласно этой трактовке, фазовые переходы II рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, никеля) при определенных давлении и температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, характеризуемое
скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия (гелия I) при Т — 2,9 К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтекучести.
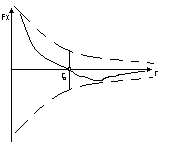
Твёрдое тело — это агрегатное состояние вещества, характеризующееся стабильностью формы и характером теплового движения атомов, которые совершают малые колебания около положений равновесия. Различают кристаллические и аморфные твердые тела (см.дальний и ближний порядок). Кристаллы характеризуются пространственною периодичностью в расположении равновесных положений атомов. В аморфных телах атомы колеблются вокруг хаотически расположенных точек. Согласно классическим представлениям, устойчивым состоянием (с минимумом потенциальной энергии) твёрдого тела является кристаллическое. Аморфное тело находится вметастабильном состоянии и с течением времени должно перейти в кристаллическое состояние, однако время кристаллизации часто столь велико, что метастабильность вовсе не проявляется.
