
- •Глава 1. Общие вопросы отбора, консервирования и подготовки проб воды к анализу
- •Питьевая вода и вода для промышленных целей Требования, предъявляемые к воде
- •Питьевая вода
- •Вода для промышленных целей
- •Отбор проб воды и пробоподготовка их к анализу
- •Виды отбора проб
- •Виды проб
- •Оборудование для отбора проб воды
- •Отбор проб воды из различных источников
- •Консервирование проб
- •2.10. Определение цветности воды
- •1. Визуальное определение цветности
- •2. Фотоэлектроколориметрическое определение цветности
- •1. Приготовление растворов.
- •2. Приготовление имитационной шкалы цветности.
- •3. Выбор условий определения.
- •4. Построение градуировочного графика.
- •5. Определение цветности анализируемой воды.
- •2.12. Определение кислорода, растворенного в воде. Бпк
- •1. Калибрование кислородной склянки.
- •2. Определение растворенного кислорода.
- •3. Определение бпк
- •3.1. Определение нитритов в воде.
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2.
- •4. Приготовление серии стандартных растворов.
- •5. Подготовка пробы анализируемой воды.
- •6. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации нитритов в пробе
- •.6. Определение хлоридов в воде
- •1. Определение хлорид ионов в воде методом осаждения
- •2. Определение хлоридов в воде потенциометрическим методом анализа
- •1) Приготовление основного раствора.
- •2) Приготовление серии стандартных растворов.
- •3) Приготовление фонового раствора.
- •4) Измерение эдс стандартных растворов на приборе рН-340
- •5) Построение градуированного графика в координатах
- •6) Определение концентрации хлоридов в пробе воды.
- •7) Таблица результатов
- •3.7. Определение железа в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуировочного графика
- •7. Определение концентрации железа в пробе
- •3.8. Определение хрома в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора № 1
- •3. Приготовление рабочего раствора № 2
- •4. Приготовление серии стандартных растворов
- •5. Подготовка пробы анализируемой воды
- •6. Выбор условий определения
- •7. Построение градуировочного графика
- •8. Определение концентрации хрома в воде
- •3.10. Определение алюминия в воде
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов.
- •4. Подготовка пробы анализируемой воды.
- •5. Выбор условий определения
- •7. Построение градуированного графика
- •8. Определение концентрации алюминия в пробе
- •3.14. Определение кальция в воде
- •4.1. Определение фенолов в воде
- •Определение летучих с паром фенолов (определение относительно больших концентраций)
- •1. Приготовление основного раствора
- •2. Приготовление рабочего раствора
- •3. Приготовление серии стандартных растворов
- •4. Подготовка пробы анализируемой воды
- •5. Выбор условий определения
- •6. Построение градуированного графика.
- •7. Определение концентрации фенола в воде
4) Измерение эдс стандартных растворов на приборе рН-340
Измерения проводят в порядке возрастания концентрации. После каждого измерения электроды промывают дистиллированной водой и осушают фильтровальной бумагой.
В стакан последовательно наливают 40 мл каждого из стандартных растворов и по 10 мл фонового раствора, перемешивают, погружают электроды на 1 см и измеряют ЭДС.
Ручку «размах» устанавливают в положение «1500 mV». По нижней шкале, показывающего прибора, определяют интервал измерения. Ручку
«интервалы измерения» устанавливают на соответствующий интервал. Ручку «размах» переключают в положение «300 mV» и берут отсчет по верхней шкале показывающего прибора. Показания, отсчитанные в любом диапазоне измерений, необходимо умножить на 100.
5) Построение градуированного графика в координатах
ЭДС (∆φ) – lgС(Cl)

6) Определение концентрации хлоридов в пробе воды.
В стакан наливают 40 мл анализируемой воды и 10 мл фонового раствора, перемешивают, погружают электроды на 1 см и измеряют ЭДС анализируемой воды.
По градуировочному графику находят величину lgС(Cl) и рассчитывают концентрацию хлорид ионов в мг/л.
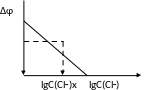
C(Cl)
=

7) Таблица результатов
№ |
C(Cl), мг/л |
lgС(Cl) |
∆φ |
1 2 3 4 5 6 |
1000 300 100 30 10 х |
3 2,5 2 1,5 1 х |
|
х – результаты анализа пробы
Примечание. Все измерения на приборе проводят по три раза.
Вычисляют средний результат.
3.7. Определение железа в воде
Железо – природная составная часть поверхностных и подземных вод, и концентрация его в этих водах зависит от геологического строения и гидрологических условий бассейна. Главными источниками соединений железа в природных водах являются процессы химического выветривания и растворения горных пород. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности, с сельскохозяйственными стоками.
При водоснабжении для питьевых и хозяйственно-бытовых нужд высокое содержание железа в воде вызывает технические затруднения.
Железо в воде присутствует в растворимой и нерастворимой формах, как в свободном виде, так и в виде комплексов с неорганическими и органическими лигандами, главным образом с гуминовыми кислотами. Концентрация железа в поверхностных пресных водах составляет обычно десятые доли миллиграмма, в болотных водах, где концентрация гумусовых веществ достаточно велика, единицы миллиграммов.
Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме.
При содержании железа выше 1 мг/л вода становится мутной, окрашивается в желто-бурый цвет, у нее ощущается характерный металлический привкус. Такая вода практически неприемлема как для технического, так и для питьевого применения. По органолептическим признакам предел содержания (ПДК) железа в воде практически повсеместно установлен на уровне 0,3 мг/л (по нормам ЕС даже 0,2 мг/л). По показаниям вредности для здоровья такой параметр не установлен.
Железо в воде можно определять в виде Fe2+ и Fe3+. Обычно определяют общее содержание железа, для этого пробу воды окисляют концентрированной азотной кислотой (Fe2+ переходит в Fe3+). Объем пробы воды для определения массовой концентрации железа должен быть не менее 200 мл. Пробу не консервируют при проведении анализа в течении 4 часов, если это невозможно ее консервируют 2-4 мл хлороформа или 3 мл концентрированной HCl или HNO3 на 1 литр воды и хранят пробу в течении 2 суток.
Определение железа в воде проводят фотоэлектроколориметрическим методом. Фотоэлектроколориметрический метод анализа основан на зависимости светопоглощения раствора от его концентрации. Использование света видимой области спектра в данном методе дает возможность анализировать окрашенные вещества или вещества, которые можно перевести в окрашенные растворы.
В основе фотоэлектроколориметрического метода анализа лежит закон Бугера–Ламберта–Бера: абсорбционность прямо пропорциональна концентрации раствора и толщине поглощающего слоя.
А = Е . L . С,
где А - абсорбционность,
Е - молярный коэффициент поглощения (абсорбционности),
L - толщина поглощающего слоя,
С - концентрация раствора.
Определение содержания железа проводят на приборе КФК-2 или КФК-3. На приборах работают в видимой области спектра. Видимая область спектра лежит в диапазоне длин волн 400-750 нанометров (нм).
Сущность метода определения
Метод основан на образовании окрашенного иона при взаимодействии Fe3+ с сульфосалициловой кислотой. При рН = 8 - 10 комплексный ион железа образует желтый раствор.
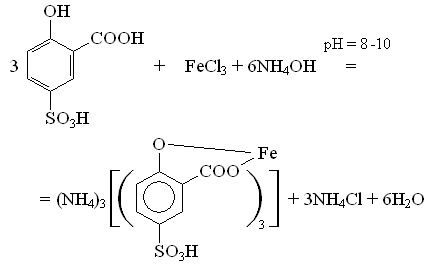
Область обнаружения железа данным методом составляет 0,1 - 1 мг/л.
Ход работы
