
2 Міжатомна взаємодія
1 .
В іонному кристалі пара протилежно
заряджених двовалентних іонів знаходиться
у рівноважному стані на відстані 2,40
.
В іонному кристалі пара протилежно
заряджених двовалентних іонів знаходиться
у рівноважному стані на відстані 2,40
![]() один від одного. Припускаючи, що в
рівнянні для енергії взаємодії іонів,
яка визначає іонний зв’язок і описується
виразом
один від одного. Припускаючи, що в
рівнянні для енергії взаємодії іонів,
яка визначає іонний зв’язок і описується
виразом
![]() ,
n = 9, знайти енергію, яка необхідна для
розділення іонів.
,
n = 9, знайти енергію, яка необхідна для
розділення іонів.
Д ано:
Рішення
ано:
Рішення
Z1 = Z2 = 2
n = 9
е = 1,6·10-19Кл
а = 2,40
= 2,40·10-10м
= 2,40
= 2,40·10-10м
W -?
Для розділення іонів їм необхідно надати енергію, яка дорівнює енергії зв’язку. З формули, що визначає фізичний зміст енергії зв’язку, можна знайти її величину, як роботу потрібну для розділення іонів:
 (1)
(1)
У рівноважному стані енергія взаємодії іонів мінімальна. Тоді з умов мінімуму потенціальної енергії U знайдемо константу b:
 ,
,
звідси
![]() (2)
(2)
Тоді з урахуванням виразу (2), рівняння (1) запишеться:
![]()
 Дж
=21,3 еВ
Дж
=21,3 еВ
2 .
З якою силою притягуються між собою
сусідні іони цезію та хлору в кристалі
хлористого цезію, який має густину 2,3
г/см3?
Молярна маса цезію 132,9·10-3
кг/моль, а хлору 35,4·10-3кг/моль.
.
З якою силою притягуються між собою
сусідні іони цезію та хлору в кристалі
хлористого цезію, який має густину 2,3
г/см3?
Молярна маса цезію 132,9·10-3
кг/моль, а хлору 35,4·10-3кг/моль.
Д ано:
Рішення
ано:
Рішення
ρ = 2,3г/см3 = 2,3·103кг/м3
МСs = 132,9·10-3кг/моль
МСl = 35,4·10-3кг/моль

F - ?
СsCl є іонним кристалом, тому взаємодія між іонами Сs і Cl являється кулонівською, а сила їх протягування описується законом Кулона:
![]()
Враховуючи, що q1 = q2 = е, ε = 1, можна записати:
![]() (1)
(1)
Структура СsCl уявляє собою сукупність двох примітивних кубічних решіток Браве з іонів Сs і Cl, які зсунуті одна відносно іншої на половину довжини просторової діагоналі куба. Тому в цьому кристалі можна виділити комірку у вигляді об’ємноцентрованого куба, в якій кожний позитивний іон цезію оточений вісьмома негативними іонами хлору.
Знайдемо r. З рисунку бачимо, що
![]() (2)
(2)
Знайдемо об’єм одного моля кристала СsCl, враховуючи, що на об’єм однієї комірки а3 припадає n молекул СsCl, тоді:
![]() ,
або
,
або
![]() ,
(3)
,
(3)
де
![]() кг/моль
– молярна маса кристала СsCl.
кг/моль
– молярна маса кристала СsCl.
Знайдемо
кількість молекул СsCl
в об’ємі а3,
враховуючи, що кожний з восьми іонів Cl
у вершинах куба належить восьми коміркам,
тобто
![]() ,
а іон Сs
належить тільки одній комірці. Тому на
об’єм а3
припадає один іон Сs
і один іон Cl.
Таким чином, одна молекула СsCl
міститься в об’ємі а3,
отже n
= 1. Тоді, прирівнюючи формули (3), отримаємо:
,
а іон Сs
належить тільки одній комірці. Тому на
об’єм а3
припадає один іон Сs
і один іон Cl.
Таким чином, одна молекула СsCl
міститься в об’ємі а3,
отже n
= 1. Тоді, прирівнюючи формули (3), отримаємо:
![]() .
.
Звідки
![]() (4)
(4)
Остаточно, підставляючи формулу (2) в (1), з урахуванням (4), маємо:
 Н
Н
3. При
температурі, яка на 100С
менша температури плавлення алюмінію
![]() ,
на долю вакансій припадає 0,08% місць в
кристалічній решітці, а при 4840С
– тільки 0,01% місць. Знайти енергію
утворення вакансій і концентрацію
вакансій при 5270С.
Враховуючи, що температура плавлення
алюмінію 933 К, густина 2,699г/см3.
Константу С у виразі для концентрації
вакансій прийняти такою, що дорівнює
10.
,
на долю вакансій припадає 0,08% місць в
кристалічній решітці, а при 4840С
– тільки 0,01% місць. Знайти енергію
утворення вакансій і концентрацію
вакансій при 5270С.
Враховуючи, що температура плавлення
алюмінію 933 К, густина 2,699г/см3.
Константу С у виразі для концентрації
вакансій прийняти такою, що дорівнює
10.
Д
 ано:
Рішення
ано:
Рішення
ΔТ = 100С = 10К
М = 27·10-3кг/моль
![]()
Т2 = 4840С + 273 = 757К
![]()
Т3 = 5270С + 273 = 800К
Тпл = 933К
Ρ = 2,699г/см3 = 2,699·103кг/м3
С = 10
= 10
Е - ? n2 - ?
Кількість вакансій в кристалі залежить від температури експоненційно:
![]() ,
(1)
,
(1)
де N0
– кількість атомів у вузлах ідеальної
кристалічної решітки. Логарифмуємо
рівняння (1), записавши його для температур
Т1
і Т2
та
розв’язуючи їх сумісно, знайдемо енергію
утворення вакансій Е.
Враховуємо, що
![]() К:
К:
![]() ,
,
![]() ,
,
звідси
![]() Дж
= 0,75еВ
Дж
= 0,75еВ
Концентрацію
вакансій при температурі Т3
знайдемо з рівняння (1), враховуючи, що
![]() ,
,
![]() ,
або
,
або
![]() :
:
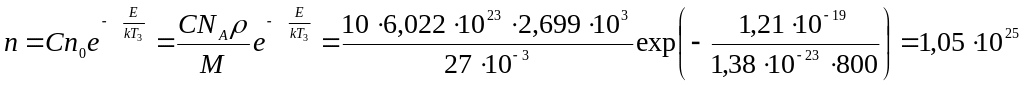 м-3
м-3
