
- •Химические аспекты экологии
- •Глава 1. Химия атмосферы_____________________________ 6
- •Глава 2. Химия гидросферы____________________________ 38
- •Введение
- •Глава 1. Химия атмосферы
- •1.1. Физико-химические свойства атмосферы
- •1.2. Химические процессы в атмосфере
- •1.3. Меры по предотвращению загрязнения воздуха.
- •1.4. Источники информации, ключевые слова, вопросы для самоконтроля
1.2. Химические процессы в атмосфере
Верхние слои атмосферы
Несмотря на то, что масса верхних слоев атмосферы незначительна, именно они определяют условия жизни на поверхности Земли. Они играют
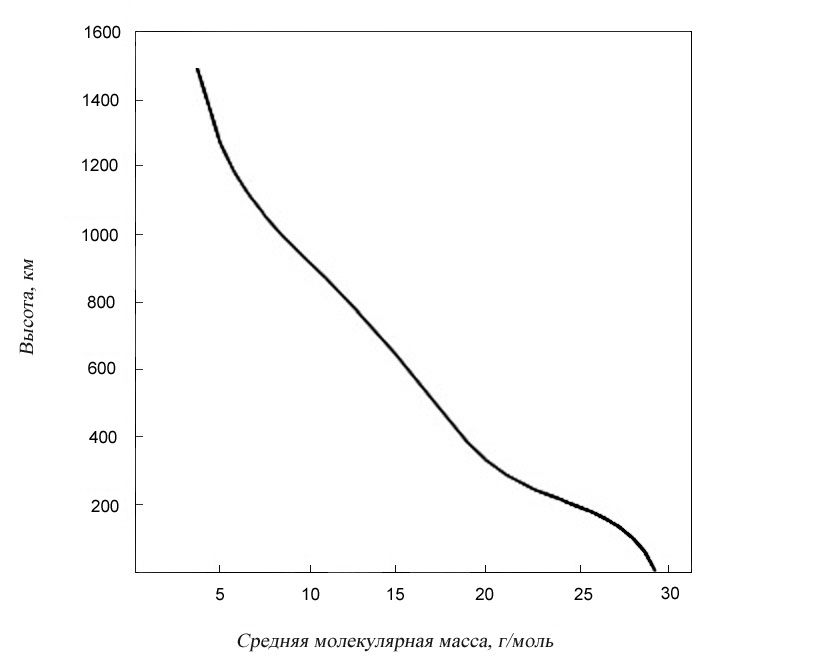
Рис. 1.2. Зависимость средней молекулярной массы атмосферы от высоты над поверхностью Земли
роль защитного барьера на пути излучений и частиц высокой энергии. Поглощая солнечную радиацию, молекулы и атомы подвергаются фотохимическим превращениям. Для протекания фотохимических реакций в атмосфере необходимо, чтобы выполнялись следующие условия. Во-первых, энергия фотонов должна быть достаточной для инициирования процесса (разрыва химической связи в молекуле, отрыва электрона и т. д.). Во-вторых, молекула должна поглощать фотоны.
Начинаются эти процессы на высоте 250 км. Одним из наиболее важных процессов в верхних слоях атмосферы является фотодиссоциация, в частности, диссоциация молекул кислорода:
О2 + hν → О + О (1.3)
Протекание этой реакции приводит к тому, что на высотах более 100 км кислород находится как в молекулярной, так и в атомарной формах.
Используя формулы Е = hν и ν∙λ = С, можно рассчитать ν (λ) фотона, способного вызвать диссоциацию молекулы О2. Энергия диссоциации О2 равна 495 кДж/моль. Расчеты показывают, что любой фотон с длиной волны менее 242 нм имеет достаточную для разрыва связи О – О энергию.

Рис. 1.3. Кислородный состав атмосферы на разных высотах
На рис. 1.3 показан кислородный состав атмосферы в зависимости от высоты. На больших высотах диссоциация О2 осуществляется интенсивно. На высоте 400 км диссоциированы 99 % молекул кислорода, на высоте 130 км содержание О2 и О приблизительно одинаково. На меньших высотах содержание О2 превышает содержание О.
Молекулы азота имеют очень высокую энергию диссоциации и плохо поглощают фотоны, поэтому в верхних слоях атмосферы образуется очень мало атомарного азота.
Фотодиссоциации в верхних слоях подвергаются и молекулы воды:
H2O + hν → H + OH OH + hν → H + O (1.4)
Ученые считают, что подобные реакции сыграли определенную роль в формировании кислородной атмосферы.
Другим важным процессом в верхних слоях атмосферы является фотоионизация (реакция поглощения фотона с последующим отрывом электрона). В табл. 1.3 указаны важнейшие процессы ионизации, протекающие на высоте более 90 км. Там же приведены соответствующие энергии ионизации и максимальные длины фотонов, способные вызвать ионизацию.
Таблица 1.3. Процессы ионизации в верхних слоях атмосферы
Процесс |
Энергия ионизации, кДж/моль |
λ max,нм |
N2 + hν
→ N2+ +
О2 + hν → О2+ + О + hν → О++ NO + hν → NO+ + |
1495 1205 1313 890 |
80,1 99,3 91,2 134,5 |
Наибольшая энергия требуется для ионизации N2, а наименьшая – для NО. Поглощаемое в этих реакциях жесткое УФ–излучение не достигает поверхности Земли. Кроме того, верхняя часть атмосферы "ионизируется", т.е. насыщается свободными ионами и электронами.
Образующиеся ионы обладают большой реакционной способностью. Они вступают далее в разнообразные реакции, большинство из которых экзотермичны и протекают безактивационно. Наиболее важные из такого рода реакций: диссоциативная рекомбинация, перенос заряда, реакции обмена.
Рекомбинация представляет собой процесс, обратный ионизации, сопровождающейся выделением большого количества энергии. Если нет возможности передать эту энергию (например, какой–либо другой молекуле, что маловероятно в верхних слоях атмосферы), то она вызывает диссоциацию данной молекулы:
N2+ + → N + N (1.5)
O2+ + → O + O (1.6)
NO+
+
![]() →
N + O (1.7)
→
N + O (1.7)
Атомарный азот в верхних слоях атмосферы образуется главным образом в результате диссоциативной рекомбинации.
Перенос заряда ( ) может произойти при столкновении молекулярного иона с какой–либо молекулой. Для того, чтобы такая реакция произошла, необходимо, чтобы энергия ионизации теряющей электрон частицы была меньше энергии ионизации молекулы, образующейся в результате переноса заряда.
O+ + O2 → О + O2+ (1.8)
O2+ + NO → O2 + NO+ (1.9)
N2+ + NO → N2 + NO+ (1.10)
Так как молекула N2 имеет самую высокую энергию ионизации по сравне-нию с другими частицами (см. табл. 1.3), ион N2+ способен вступать в реакцию переноса заряда с любой молекулой. Концентрация ионов N2+ очень мала.
Реакции обмена сопровождаются не только переносом электрона от одной частицы к другой, но и разрывом связи (обменом атомов):
O+ + N2 → NO+ + N (1.11)
N2+ + O → NO+ + N (1.12)
Ион NO+ самый распространенный в верхних слоях атмосферы, несмотря на то, что относительная концентрация NO составляет всего около одной миллионной доли, так как энергия ионизации молекулы NO ниже, чем у других частиц. Единственный процесс, приводящий к разрушению этого иона, – диссоциативная рекомбинация.
Мезосфера и стратосфера
Большая часть коротковолнового излучения отфильтровывается в верхних слоях атмосферы, однако на высоте ~ 90 км излучение, способное вызвать диссоциацию O2, еще достаточно интенсивно.
Химические процессы, протекающие в этой области атмосферы, значительно отличаются от процессов, протекающих на больших высотах. Наиболее значимые из стратосферных реакций – реакции озонового цикла. В мезо- и стратосфере концентрация O2 намного превышает концентрацию атомарного кислорода (см. рис. 1.3), что приводит к столкновению и взаимодействию этих частиц:
О + O2 ↔ O3* (1.13)
Двойная стрелка указывает на обратимый характер процесса.
Колебательно возбужденная молекула O3* легко распадается на исходные частицы. Но с уменьшением высоты возрастает вероятность стабилизирующего столкновения O3 с "третьей" частицей М (чаще всего это O2 или N2), сопровождающегося тепловым рассеянием энергии:
O3* + М → O3 + М (1.14)
В то же время из-за снижения интенсивности излучения уменьшается скорость образования атомарного кислорода по реакции (1.3). Кинетикой этих конкурирующих реакций и определяется судьба O3* в стратосфере. Скорость образования озона максимальна на высоте около 50 км.
Реакции образования O3 уравновешиваются реакциями, в ходе которых O3 разрушается. Одна из таких реакций, также приводящая к тепловому рассеиванию энергии, может быть записана следующим образом:
О + O3 → 2O2 (1.15)
Наряду с реакцией (1.15) происходит еще одна важная деструктивная реакция озона – фотолиз (фоторазложение О3):
O3 + hν → О + O2 , (1.16)
где hν – излучение с длиной волны от 200 – 310 нм. Другие атмосферные газы в указанной области спектра поглощают не столь эффективно. Поэтому озоновый слой выполняет роль своеобразного щита. *
Процесс образования и разложения озона называют циклом Чэмпена:
О2 + hν → O + O (1.17)
O + O2 + М → O3 + M + 107 кДж/моль | x 2 (1.18)
О + O3 → 2O2 + 391 кДж/моль (1.19)
O3 + hν → O2 + O (1.20)
Сумма этих реакций приводит к нулевому циклу:
hν + hν = ∆Н1 + ∆Н2 = – 605 кДж/моль (1.21)
В нулевом цикле не происходит изменения химического состава системы. Общим результатом этого цикла является то, что УФ–излучение Солнца превращается в тепловую энергию. Озоновый цикл ответственен за повышение температуры в стратосфере.
В озоновый цикл кроме кислорода вовлекаются и другие соединения, являющиеся катализаторами разложения O3. В общем виде протекание этих реакций можно выразить уравнениями:
O3 + Y → YО + O2 (1.22)
YO + O → Y + O2 (1.23)
O3 + O → 2O2 + 391 кДж/моль, (1.24)
где Y = NO, Cl, Br, OH. Происхождение этих частиц в стратосфере возможно как в результате естественных процессов, так и в результате антропогенных загрязнений. Так, например, только 25% атомарного хлора переносится в стратосферу из природных источников в виде метилхлорида (CH3Cl). Остальное его количество образуется при фотодиссоциации хлорфторуглеродов (ХФУ), используемых в качестве распылителей, хладоагентов и т. д.:
СFxCl4
– x
![]() CFxCl3
– x
CFxCl3
– x
![]() CFxCl2
– x
(1.25)
CFxCl2
– x
(1.25)
В 30–60 раз более разрушителен для озона, чем хлор, атомарный бром, который образуется при фоторазложении бромистого метила CH3Br, используемого в виде добавки к автомобильному топливу. Важным в протекании каталитических реакций стратосферного озона является то, что единственная молекула загрязнителя может стать причиной разрушения большого количества молекул О3. К этому стоит добавить, что разрушительное действие частиц усиливается из–за малой скорости их выведения из атмосферы (см. табл. 1.2).
В настоящее время нарушение равновесия образования и разложения О3 в стратосфере носит пока локальный характер (образование "озоновых дыр"). Уменьшение концентрации озона может привести к значительному изменению интенсивности УФ–излучения, изменению облачного покрова Земли, нарушению теплового баланса атмосферы, различным биологическим и геохимическим изменениям, которые могут оказаться критическими для биосферы.
Результирующая всех реакций разложения и образования О3 в стратосфере в сочетании с атмосферной турбулентностью и другими факторами является кривая распределения озона, называемая озоновым профилем (рис. 1.4). Измеряется содержание озона в единицах Добсона (соответствует концентрации озона, равной одной части на миллиард по объему смеси - ppb). Наименьшее содержание – над экваториальным поясом (230 единиц). С увеличением широты оно возрастает до 500 единиц.

Рис. 1.4. Схема вертикального распределения озона
Тропосфера
Пожалуй, наиболее сложно организованные реакционные системы образуются (возникают) на дне воздушного океана – в тропосфере. Причем основная роль в тропосферных реакциях отводится примесным компонентам, даже если они присутствуют в следовых количествах. Связано это с тем, что основные компоненты тропосферы не взаимодействуют с излучением при λ>300 нм. Как отмечалось выше, излучение меньшей длины волны почти полностью поглощается реакциями фотодиссоциации озона и кислорода.
Превращение загрязняющих веществ в тропосфере – один из способов (путей) ее самоочищения. Но необходимо отметить, что подобные взаимодействия могут повлечь за собой и существенные изменения окружающей среды. Пока масштабы антропогенных и техногенных загрязнений меньше естественных и носят локальный характер.
Тем не менее следует учитывать, что примесные компоненты атмосферы очень быстро распространяются на значительные расстояния. Считается, что концентрация загрязняющих веществ в районах дымовых труб прямо пропорциональна количеству выбрасываемого вещества и обратно пропорциональна квадрату высоты дымовой трубы. Степень разбавления газовых выбросов зависит не только от расстояния, но и от розы ветров, и от погодных условий.
Так, например, на территории Великобритании и ФРГ осаждается от 1/10 до 1/3 доли (части) выбрасываемой трубами предприятий серы, тогда как в скандинавских странах выпадает в виде кислотных дождей в 2–3 раза больше серы, чем ее выбрасывают собственные предприятия. Это связано с тем, что химические превращения оксидов серы и азота протекают сравнительно медленно. Максимальная концентрация H2SO4 – на расстоянии 250 – 300 км от места выброса. Еще удаленнее (500 – 1000 км от места выброса) максимумы концентрации сульфатов.
В настоящее время наибольшие опасения вызывают следующие негативные явления и процессы в атмосфере: повышение концентрации диоксида углерода, увеличение концентрации атмосферных аэрозолей, загрязнение атмосферы оксидами серы и азота, ХФУ, тяжелыми металлами, радиоактивными веществами, рост тепловыделения за счет хозяйственной деятельности людей. Уровень загрязнения определяется массой и вредностью загрязнителей, поступающих в воздух, их концентрацией, временем пребывания, механизмами удаления из атмосферы.
Можно выделить два типа химических превращений веществ, загрязняющих тропосферу, – газофазное и жидкофазное окисление в атмосферной влаге. Механизм протекающих процессов – преимущественно радикально-цепной. Образование радикалов происходит в результате фотохимических процессов. Наиболее распространенные частицы и молекулы, инициирующие протекание тропосферных реакций: ОН-радикал гидропероксидный радикал (НО2), озон (О3), атомарный кислород, пероксид водорода (Н2О2), триоксид азота (NO3) и т. д.
Ключевое место в газофазных реакциях занимает ОН-радикал как наиболее реакционноспособная частица. Концентрация его в тропосфере составляет (0,5–5)∙106 см–3. Он может вступать в реакцию со многими соединениями в атмосфере, например, с NO и NO2 с образованием азотной кислоты, с СО и углеводородами (УВ).
Установлено, что газы, у которых скорости реакций с радикалами ОН низкие, имеют большое время пребывания в атмосфере (см. табл. 1.2). Накапливаясь в тропосфере, они со временем попадают в стратосферу и там участвуют в каталитических реакциях разложения О3.
Загрязнители делятся на первичные и вторичные. Первичными загрязнителями называются вещества, непосредственно выбрасываемые в тропосферу (взвеси, аэрозоли, УВ и другие летучие органические вещества, угарный газ СО, оксиды азота NOx, диоксид серы SO2, свинец и другие тяжелые металлы). Вторичные загрязнители образуются в результате превращений первичных. К ним относятся озон, кислоты H2SO4, HNO3, фотохимический смог. В табл. 1.4 приведены основные первичные загрязнители атмосферы и причины их появления.
Самыми масштабными из первичных загрязнителей являются продукты сгорания топлив. Они оказывают существенное давление на окружающую среду, повышая риск возникновения экологических кризисов и катастроф не только на локальном, но и на глобальном уровне. Разработка мероприятий, позволяющих снизить поступление такого рода загрязнений, – одна из приоритетных задач химии и химической технологии.
Продукты сгорания различаются в зависимости от состава и способа сжигания ископаемого топлива, температуры пламени. По механизму образова-ния их можно классифицировать следующим образом: 1) углеродсодержащие вещества; 2) вещества, выброс которых связан с примесями, содержащимися в топливе; 3) вещества, попутно образующиеся из компонентов среды в зоне сгорания.
Углеродсодержащие вещества – продукты полного и неполного сгорания топлива. Реакция горения топлива схематично может быть представлена в виде:
CxHy + zO2 → aC +bCO + cCO2 +y/2H2O , (1.26)
где x = a + b + c; z = b/2 + c +y/4. Основные продукты горения – СO2 и H2О. Они не относятся к слишком опасным. Однако интенсивное сжигание топлива и все возрастающая антропогенная эмиссия СO2 и H2О в атмосферу может оказать существенное влияние на климат всей планеты. Поэтому не случайно их относят к загрязнителям глобального масштаба.
Таблица 1.4. Основные примесные компоненты атмосферы
Примесь |
Причины появления |
Концентрация |
Диоксид углерода CO2
Монооксид углерода CO
Метан СH4
Монооксид азота NO
Озон O3
Диоксид серы SO2 |
Разложение органического вещества; эмиссия биосферной суши и океана; сжигание ископаемого топлива
Разложение органического вещества; промышленные процессы; сжигание топлива
Разложение органического вещества; утечка природного газа
Электрические разряды; работа двигателей внутреннего сгорания; сжигание органических веществ
Электрические разряды; диффузия из стратосферы; фотохимический смог
Вулканическая деятельность; лесные пожары; бактериальная деятельность; сжигание ископаемого топлива; промышленные процессы (выплавка металлов из руд и т.п.) |
320 ppm по всей тропосфере
0,05 ppm в незагрязненном воздухе; 1 – 50 ppm на городских магистралях
1 – 2 ppm во всей тропосфере
0,01 ppm в незагрязненном воздухе; 0,2 ppm в фотохимическом смоге
0 – 0,01 ppm в незагрязненном воздухе; 0,5 ppm в фотохимическом смоге
0 – 0,1 ppm в незагрязненном воздухе; 0,1 – 2 ppm в загрязненной городской атмосфере |
При недостатке кислорода или невысоких температурах образуется ряд токсичных соединений углерода: монооксид углерода (угарный газ), сажа (С), полициклические ароматические УВ (ПАУ), являющиеся канцерогенами, из которых наибольшей активностью обладает бенз(α)пирен C20H12. Гипотетическая реакция образования С20 Н12 при пиролизе УВ при температуре более 873 К может быть записана в виде:
C6H2 + 3C2H2 + 4C2H → C20H12 , (1.27)
где C6H2 - полирадикал, представляющий зародыш сажи; C2H2, C2H – элемент-ные строительные блоки.
Сажа – компонент дыма, возникающего при интенсивном горении. Она представляет собой смесь маслянистых веществ и твердого углерода – абсолютно черного вещества, играющего определенную роль в процессе поглощения света.
Чем чернее дым, тем больше в нем углерода. Количество дыма и сажи, образующихся при горении, зависит от качественного состава топлива.
Монооксид углерода – один из основных загрязнителей по массе (см. табл. 1.4). Образуется при неполном сгорании углеводородных топлив с некоторым недостатком воздуха, а также при диссоциации CO2 (при температуре 2000 К). Это соединение обладает специфической способностью прочно связываться с гемоглобином (Hb) крови, являющимся переносчиком O2. Как известно, в легких Hb захватывает O2 и, образуя вещество, называемое оксигемоглобином, в тканях его высвобождает.
Способность СО связываться с Hb и образовывать карбоксигемоглобин в 210 раз выше, чем у O2. Вследствие этого относительно небольшое количество СО может блокировать существенную часть Hb крови и вызвать кислородную недостаточность у организма. При концентрации СО 100 ppm появляется головная боль, случаются обмороки. На городских магистралях концентрация СО достигает 50 ppm, а в пробках может повышаться до 140 ppm. Курение является одной из наиболее серьезных причин отравления СО, т.к. в сигаретном дыму содержится примерно 400 ppm CO.
Соединения серы относятся к веществам, выброс которых связан с примесями, содержащимися в топливе. Помимо основных элементов – углерода, водорода, кислорода, ископаемое топливо содержит чистую серу. В некоторых случаях ее содержание может доходить до 6%. При сжигании она превращается в SO2. Приблизительно 80% выделяемого SO2 обусловлено сжиганием угля и нефти. Естественные источники (разрушение биосферы с помощью анаэробных бактерий, вулканическая деятельность) дают около 12% соединений серы в атмосферу.
Несмотря на то, что концентрация SO2 в атмосфере относительно невелика, он считается наиболее опасным загрязнителем глобального масштаба. Повышенное содержание SO2 в атмосфере не только опасно для человека и всего живого, оно является причиной выпадения “кислотных дождей”.
В присутствии влаги, пылеобразных частиц оксидов металлов, выполняющих роль гетерогенного катализатора, протекает фотохимическое окисление SO2 до SO3. Двухстадийный процесс упрощенно можно представить уравнениями:
SO2 + hν → SO2* (1.28)
SO2* + O2 → SO3 + O , (1.29)
где SO2* – электронно-возбужденная молекула SO2, образующаяся при поглощении света в области 340 – 400 нм.
К образованию SO3 приводит также окисление SO2 под действием НО2-радикалов:
SO2 + HO2 → SO3 + OH (1.30)
Образующийся SO3 растворяется в капельках влаги, при этом получается серная кислота:
SO3 + Н2О → Н2SO4 (1.31)
Серная кислота обладает большим сродством к воде, поэтому капельки кислоты дополнительно адсорбируют воду, увеличиваются в объеме и превращаются в туман с низким значением pH (так называемый лондонский смог).
Следует отметить, что и в отсутствие SO2 атмосферная влага будет иметь кислую реакцию из-за растворенного СO2:
CO2 + H2O ↔ H2CO3 водн.↔ H+ + HCO3– водн.↔ 2H+ + CO32– водн. (1.32)
Если принять парциальное давление СO2 равным 336∙10–4 %, т.е. 3,6∙10–4 атм, получится концентрация водородных ионов [Н+], равная 2,4∙10–6 моль∙л–1, или pH 5,6. Диоксид серы (SO2) находится в гораздо меньших концентрациях, но он имеет большие растворимость (константу Генри) и константу диссоциации (см. табл. 1.5), поэтому при концентрации SO2 всего 5∙10–9 атм можно получить значение рН дождевых капель ниже 3.
Таким образом, переход следовых количеств загрязнителя из газовой фазы в жидкую приводит к значительному увеличению его концентрации (~ в миллион раз). Испарение воды из капель может привести к еще большему концентрированию SO3 и понижению рН. Повышение концентрации также может иметь место, если вода замерзнет. При таянии снега кислотные ионы выносятся в первую очередь, т.к. они находятся на внешней стороне капель.
Таблица 1.5. Константы Генри и первые Кдисс. атмосферных газов, претерпевающих гидролиз
Газ |
Кн ,моль∙л–1 атм–1 |
Кдисс., моль∙л–1 |
SO2 СO2 |
2,0 0,04 |
2,0∙10–2 4,0∙10–7 |
Помимо SO2 определенный вклад в появление кислотных дождей вносят оксиды азота и хлорсодержащие соединения. Вторичными продуктами реакций с их участием являются азотная (HNO3) и хлороводородная (HCl) кислоты.
Кислотные дожди вызывают необратимые изменения в экосистеме. Происходит гибель водоемов, деградация лесов, закисление почв, сопряженное с такими негативными явлениями, как снижение буферной емкости почвы, вымывание из нее биогенов, мобилизация (увеличение подвижности) Al и др. тяжелых металлов. Обращает на себя внимание тот факт, что Al, токсически безобидный элемент, при пониженных значениях рН по характеру воздействия на водные организмы и пищу ставится в один ряд с тяжелыми металлами. Связано это с распространением так называемой алюминиевой болезни, причиной которой является вытеснение алюминием из биологически активных соединений жизненно важных ионов (Mg2+,Ca2+, Na+, Fe3+).
Кислотные дожди приводят к огромным материальным потерям. Они вызывают коррозию металлических конструкций, разрушают здания, сооружения из бетона, мрамора, покрытия из краски и т.д. Разрушение мрамора и других карбонатных строительных материалов (иногда толщиной до 10 см) происходит в результате реакции:
CaCO3 + H2SO4 + H2O CO2↑ + CaSO4 ∙ 2H2O (1.33)
Гипс CaSO4∙2H2O растворим в воде. Кроме того, он образует более рыхлые структуры, чем карбонаты, в результате чего возникает вспучивание и шелушение строительного камня.
Оксиды азота и компоненты фотохимического смога относятся к веществам, механизм образования которых непосредственно не связан с процессом сгорания топлива. Они являются как бы побочными продуктами. Увеличению такого рода загрязнений способствовало использование жидкого топлива в двигателях внутреннего сгорания. Появление автомобилей привело к расширению спектра вредных следовых веществ.
В отличие от угля бензин дает мало дыма. В то же время в выхлопных газах автомобилей остается много несгоревших "активных" УВ и монооксида углерода (это связано с непродолжительным пребыванием топлива в камере двигателя внутреннего сгорания). Содержание УВ сильно зависит от характера вождения и системы зажигания и в меньшей степени – от вида горючего. Пробки на дорогах, работа двигателя вхолостую увеличивают концентрацию УВ и СО в выхлопах.
Вместе с тем высокая температура зажигательной смеси (O2, N2, CxHy) в момент зажигания способствует образованию оксидов азота (NOx, где х = 1,2). Именно они контролируют процессы образования вторичных загрязнителей автомобильного транспорта – компонентов фотохимического смога (смога лос-анджелесского типа). Фотохимический смог – это комплексная смесь, состоящая из оксидантов (в основном озона), смешанных с другими окислителями, включая слезоточивый газ – пероксиацетилнитрат (ПАН), и образующаяся из оксидов азота и УВ под действием солнечного света.
Первоначальная реакция образования смога – взаимодействие солнечного света с NO2:
NO2 + hν → NO + O (1.34)
Образующийся атомарный кислород может вступать в самые различные реакции, в том числе с молекулами кислорода, превращаясь в озон:
О2 + О + М → О3 + М* (1.35)
Озон способен быстро окислять NO до NO2, замыкая цикл без образования оксиданта:
NO + O3 → NO2 + O2 (1.36)
При наличии в воздухе УВ через посредничество ОН-радикалов происходит цикл реакций окисления органических соединений с образованием оксидантов. В присутствии NO как катализатора и воздействии света с длиной волны 300–400 нм брутто-реакцию окисления CH4 можно представить в виде:
CH4 + 4O2 = CH2O + H2O + 2O3 , (1.37)
т.е. окисление УВ (в данном случае метана) приводит к образованию тропосферного озона. Скорость этого процесса тем больше, чем выше концентрация NO. При взаимодействии озона и атомарного кислорода с УВ образуются свободные радикалы. Последние реагируют с компонентами атмосферы по цепному механизму, образуя, в свою очередь, водород-, кислородсодержащие, а также нестабильные, с высокой реакционной способностью пероксиацетиловые радикалы, являющиеся предшественниками ПАН. Эти соединения можно представить формулой:
R – О
R – C – O – O – NO2 ,
где R – CH3, C6H5 и т.д. На рис. 1.5 приведена схема трансформации первичных загрязняющих веществ автомобильных выхлопных газов в тропосфере. ПАН оказывают раздражающее действие на слизистую оболочку дыхательных путей и глаз, подавляют процесс фотосинтеза растений. Окислительная среда смога усиливает коррозию металлов.
Состав смога в городе с активными фотохимическими условиями в течение дня меняется (см. рис. 1.6). В ранние утренние часы концентрация NOx невелика. По мере усиления автомобильного движения растет концентрация NO в соответствии с реакцией (1.34), затем начинает преобладать его окисление озоном по реакции (1.36). Концентрация О3 в этот период незначительна. Она начинает увеличиваться за счет реакции (1.37) и достигает максимума в послеполуденные часы. К этому времени несгоревшие УВ окисляются до альдегидов, большая часть NOx успевает превратиться в ПАН или родственные соединения. Формирование смога останавливается при прекращении солнечной радиации.

Рис. 1.5. Схема образования пероксиацетилнитрата – компонента фотохимического смога
Газофазные компоненты смога (частицы молекулярных размеров) в результате их слипания образуют аэрозоли с последующим их осаждением (сухим или мокрым) и удалением из атмосферы. Вместе с тем вещества могут переноситься ветром на значительные расстояния. В табл. 1.6 приведены усредненные оценки масштабов рассеяния и трансформации некоторых компонентов транспортных выбросов.
Таблица 1.6. Масштабы переноса рассеивания веществ в атмосфере
Вредные вещества |
Расстояние, км |
Время рассеивания или трансформации, ч |
NO NO2, SO2 ПАН, HNO3 H2SO4 CH4 |
10 100 1000 1000 Масштаб Земли |
1 48 72 96 До 90000 |
Указанные процессы являются как быстротечными по времени, происходящими преимущественно на локальных участках, так и вялотекущими, распространяющимися на значительные расстояния. Таким образом, под влиянием транспортных загрязнений изменения в окружающей среде могут происходить как в локальном (региональном), так и общепланетарном масштабах. Наибольший вред окружающей среде наносится в непосредственной близости от автомагистралей.
Доля компонентов, млн-1
Время, ч
Рис. 1.6. Доля компонентов фотохимического смога в разное время суток:
1- углеводороды; 2 – альдегиды; 3 – озон; 4 – диоксид азота; 5 – монооксид азота
Тяжелые металлы (ртуть, свинец, кадмий) являются весьма опасными первичными загрязнителями атмосферы. Они поступают в атмосферу с дымовыми газами и отходящими газами черной и цветной металлургии. В результате антропогенной деятельности в атмосферу поступает больше металлов, чем из природных источников.
Наиболее значительное загрязнение атмосферы Pb. Самая низкая концентрация Pb 0,8 мкг/м3. Городская пыль содержит 1% Pb. В дожде и снеге содержится до 300 мг/л Pb. Ежедневно городской житель поглощает около 45 мкг Pb. До 72,3% от общего количества загрязнений Pb происходит от выхлопных газов автомобилей. Соединения Pb – тетраметилсвинец (Pb(CH3)4) или тетраэтилсвинец (Pb(C2H5)4) – прибавляются к бензину в количестве 80 мг/л в качестве антидетонационных присадок.
Токсическое действие Pb заключается в нарушении процессов обмена веществ и ингибировании ферментативных реакций. Одним из наиболее коварных последствий свинцового отравления является его способность замещать Ca в костях и нервных волокнах. Это приводит к заболеваниям нервной системы и даже поражению головного мозга. Органические соединения Pb (алкилированные формы) еще более токсичны, чем неорганические.
Парниковые газы. Выше отмечалось, что атмосфера выполняет роль защитного барьера (щита) на пути жесткого излучения, губительного для всего живого. Атмосфера выполняет еще одну важную функцию. Она является своеобразным термостатом. За поддержание теплового баланса Земли отвечают “парниковые газы”, поглощающие свет в ИК–области спектра. Именно в этой области находится максимум интенсивности излучения отражаемой земной поверхностью солнечной энергии. Главные “парниковые газы” – пары воды и диоксид углерода. В последнее время их спектр расширяется – это и CH4, N2O (закись азота), SO2, NH3, O3, полициклические фторуглероды и другие органические соединения.
В результате антропогенной деятельности концентрация парниковых газов постоянно увеличивается. И хотя климат, в конечном счете, формируется в результате воздействия многих взаимосвязанных факторов, считается общепринятым, что наиболее сильное влияние на тепловой баланс всей планеты оказывает изменение уровня содержания диоксида углерода.
Увеличение
концентрации CO2
связано с вырубкой лесов и интенсивным
сжиганием топлива (угля, нефти, газа). В
настоящее время она увеличилась на 20
%, по прогнозам, к 2050 г. она удвоится. Это
повлечет повсеместное потепление на
2,5-4,5˚С (в полярных районах до 10˚C,
в экваториальных – на 1-2˚C)
и, следовательно, таяние льдов, что, в
свою очередь, приведет к повышению
среднего уровня Мирового океана. На
рис. 1.7 показаны относительные вклады
различных газов в общее потепление за
период 1980- 1990 гг.

Рис. 1.7. Вклад каждого из парниковых газов в изменение радиационного баланса с 1980 по 1990 гг.
Аэрозольные частицы наряду с CO2, CH4 становятся глобальными загрязнителями атмосферы. Широкоизвестные аэрозоли – пыли, дымы, туманы. Они могут быть как естественного (вулканическая деятельность, пыльные бури, местные пожары, анаэробное окисление, испарение солей с поверхности океанов), так и антропогенного происхождения (выбросы различных производств, предприятий ТЭКа, двигателей внутреннего сгорания, последствия ядерных взрывов).
Аэрозоли оказывают двойное негативное воздействие на экологическое равновесие на планете, изменяя химический состав поверхностных вод, почв и влияя на прозрачность атмосферы, способность ее пропускать и поглощать излучение. Таким образом, частицы аэрозоля являются не только источником кислотности, но и управляют климатом.
Аэрозольный эффект противоположен по знаку эффекту CO2 и может оказаться в глобальных масштабах не менее существенным. Не случайно по аналогии с "шубой из CO2" в последнее время появились термины "аэрозольный холодильник" и зловеще-пугающая "ядерная зима".
Химический состав большинства аэрозолей колеблется от "чистой" туманообразной H2SO4 до сульфата аммония, образующегося в присутствии NH3 по реакции:
H2SO4
![]() (NH4)HSO4
(NH4)HSO4
![]() (NH4)2SO4
(1.38)
(NH4)2SO4
(1.38)
Как было показано (см. с. 19), один из главных процессов, приводящих к накоплению SO2 и SO42– в атмосфере, – сжигание ископаемых топлив. Но в глобальном круговороте S не менее значимым является еще один процесс – деятельность морских микроорганизмов (фитопланктона), продуцирующих летучие органические сульфиды, главным образом диметилсульфид (ДМС), который в атмосфере окисляется до SO2. И хотя химически SO2, поступающий в атмосферу при сжигании топлив или из морских биогенных источников, неразличим, с помощью метода радиационного анализа было показано, что именно фитопланктон является доминирующим источником в осуществлении контроля над климатом.
Различают прямое и косвенное воздействие аэрозоля на климат. Первое связано с поглощением солнечной энергии и ее рассеиванием частицами аэрозоля. Вторичное влияние аэрозоля заключается в том, что его частицы служат ядрами конденсации облаков и поэтому влияют на облачность и погодные условия.
Разрабатывается концепция, согласно которой фитопланктон играет роль в регулировании климата, а не только в воздействии на него. Согласно этой концепции глобальное потепление приводит к увеличению продукции ДМС. В свою очередь, это увеличивает поток ДМС в атмосферу и концентрацию аэрозоля. Повышенная облачность способствует охлаждению атмосферы, таким образом противодействуя потеплению, которое инициировало цикл. Пока эта идея, как и многие другие, нуждается в комплексной проверке.
Из других природных летучих серосодержащих соединений следует отметить карбонилсульфид COS, который устойчив к превращениям в тропосфере. Просачиваясь в стратосферу, он под действием УФ-излучения распадается с последующим образованием сернокислотных (венерианских) облаков в верхних слоях атмосферы.
