
- •5. Явления переноса
- •5.1 Столкновения молекул и явления переноса в идеальном газе
- •5.2 Основные характеристики молекулярного движения
- •5.2.1 Поперечное сечение столкновений
- •5.2.2 Среднее число столкновений и среднее время свободного пробега молекул
- •5.2.3 Средняя длина свободного пробега молекул
- •5.3 Понятие физического вакуума
5.2 Основные характеристики молекулярного движения
5.2.1 Поперечное сечение столкновений
 Молекулы
газа непрерывно и беспорядочно движутся.
Беспорядочное движение обусловлено
многочисленными столкновениями молекул.
Изменение направления движения молекулы
на заметный угол под действием другой
молекулы называют столкновением
молекул или рассеянием.
Так как столкновения молекул являются
случайными событиями, то результаты
столкновений могут быть предсказаны
лишь вероятностно. Вероятность
столкновения описывают с помощью
поперечного сечения σ
(или эффективной площади сечения
или сечения рассеяния).
Падающая частица считается точечной,
а частицы-мишени, с которыми она
сталкивается, имеют такие пространственные
размеры, что максимальная площадь их
поперечного сечения плоскостью,
перпендикулярной направлению движения
падающей частицы, равна σ,
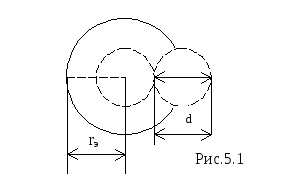
а её эффективный радиус
rэ
, равен диаметру молекулы d
(рис.5.1). Тогда поперечное сечение
рассеяния можно выразить через эффективный
диаметр молекулы:
Молекулы
газа непрерывно и беспорядочно движутся.
Беспорядочное движение обусловлено
многочисленными столкновениями молекул.
Изменение направления движения молекулы
на заметный угол под действием другой
молекулы называют столкновением
молекул или рассеянием.
Так как столкновения молекул являются
случайными событиями, то результаты
столкновений могут быть предсказаны
лишь вероятностно. Вероятность
столкновения описывают с помощью
поперечного сечения σ
(или эффективной площади сечения
или сечения рассеяния).
Падающая частица считается точечной,
а частицы-мишени, с которыми она
сталкивается, имеют такие пространственные
размеры, что максимальная площадь их
поперечного сечения плоскостью,
перпендикулярной направлению движения
падающей частицы, равна σ,
а её эффективный радиус
rэ
, равен диаметру молекулы d
(рис.5.1). Тогда поперечное сечение
рассеяния можно выразить через эффективный
диаметр молекулы:
![]()
 (5.1)
(5.1)
Это воображаемая, а не геометрическая площадь. Пусть S – площадь поперечного сечения (на рис.5.2 выделена цветом) некоторого объёма газа. В слое объёмом dV=Sdx находится N=noSdx частиц-мишеней, где no – концентрация молекул газа. Сумма их поперечных сечений dS, которая закрывает часть площади S , равна:
![]() .
.
Следовательно, вероятность того, что падающая частица попадёт в одну из частиц-мишеней в слое толщиной dx , равна:
![]() (5.2)
(5.2)
Отсюда можно выразить сечение рассеяния:
![]() (5.3)
(5.3)
Видно, что σ – воображаемая площадь и определяется вероятностью столкновения частиц. Вероятность столкновения тем выше, чем выше концентрация частиц. Следует отметить слабую зависимость σ от температуры [1,2]. Чем выше температура, тем выше кинетическая энергия теплового движения молекул, тем меньшие отклонения от первоначального движения испытывают молекулы, то есть тем меньше вероятность столкновения и, следовательно, тем меньше сечение рассеяния.
5.2.2 Среднее число столкновений и среднее время свободного пробега молекул
Определим
среднее число столкновений молекулы
газа за одну секунду. Положим, что
молекулы-мишени равномерно распределены
по объёму с концентрацией n.
Пусть все молекулы, кроме одной, покоятся.
Тогда движущаяся молекула за одну
секунду пройдёт расстояние, численно
равное средней скорости
![]() ,
и столкнётся со всеми молекулами, которые
окажутся на её пути. Это будут те молекулы,
центры которых расположены в объёме
цилиндра, длиной
,
и столкнётся со всеми молекулами, которые
окажутся на её пути. Это будут те молекулы,
центры которых расположены в объёме
цилиндра, длиной
![]() и площадью основания σ
(рис.5.3).Объём
этого цилиндра равен
и площадью основания σ
(рис.5.3).Объём
этого цилиндра равен
![]() ,
а число молекул в нём равно
,
а число молекул в нём равно
![]() .
Таким же будет число столкновений,
которое испытывает молекула. Если
учесть, что движутся все молекулы в
выделенном объёме, то при подсчёте числа
столкновений нужно учитывать не
абсолютную скорость (относительно
стенок сосуда), а относительную скорость
молекулы, то есть скорость относительно
тех молекул, с которыми она сталкивается.
Определим относительную скорость двух
молекул, движущихся со скоростями
.
Таким же будет число столкновений,
которое испытывает молекула. Если
учесть, что движутся все молекулы в
выделенном объёме, то при подсчёте числа
столкновений нужно учитывать не
абсолютную скорость (относительно
стенок сосуда), а относительную скорость
молекулы, то есть скорость относительно
тех молекул, с которыми она сталкивается.
Определим относительную скорость двух
молекул, движущихся со скоростями
![]() и
и
![]() :
:![]() (см.[3]). Возведём в квадрат обе части
последнего равенства и получим:
(см.[3]). Возведём в квадрат обе части
последнего равенства и получим:
![]()
 .
.
Усредним это уравнение
и получим:
![]() .
Учтём, что
.
Учтём, что
![]() ,
а
,
а
![]() ,
получим
,
получим
![]() .
.
Учитывая это, среднее число столкновений молекулы за одну секунду равно:
![]() (5.4)
(5.4)
С учётом формулы (5.1) получим:
![]() (5.5)
(5.5)
В системе интернациональной единица измерения Z0 равна с - 1.
Среднее число столкновений за секунду, испытываемое всеми N молекулами определяют с учётом того, что в столкновениях участвуют пары молекул, а вероятностью столкновения трёх и более молекул пренебрегают:
![]() (5.6)
(5.6)
Среднее число столкновений молекул за время t:
![]() (5.7)
(5.7)
Зная среднее число столкновений одной молекулы за секунду Z0 , можно найти время между двумя последовательными соударениями молекулы – время свободного пробега :
![]() (5.8)
(5.8)
