
- •Введение
- •Предмет молекулярной физики
- •Молекулярное представление о веществе
- •2.1. Основные положения мкт и основные характеристики молекул.
- •Агрегатные состояния вещества
- •2.2. Основы молекулярно-кинетической теории идеальных газов
- •2.2.1 Модель идеального газа
- •2.2.2 Основное уравнение молекулярно-кинетической теории идеального газа. Давление.
- •Литература:
Агрегатные состояния вещества
 Наличие
разных агрегатных состояний вещества
объясняется различным взаимодействием
молекул. На рис. 2.1 приведена зависимость
сил межмолекулярного взаимодействия
от расстояния.
Наличие
разных агрегатных состояний вещества
объясняется различным взаимодействием
молекул. На рис. 2.1 приведена зависимость
сил межмолекулярного взаимодействия
от расстояния.
На больших расстояниях преобладает действие сил притяжения, на малых - отталкивания. По природе эти силы - электромагнитные. С энергетической точки зрения, чем больше кинетическая энергия атомов, тем сильнее тенденция к разъединению, отталкиванию; чем больше потенциальная энергия сцепления, тем больше тенденция к соединению.
Если суммарная кинетическая энергия атомов и молекул много больше суммарной потенциальной энергии их взаимного притяжения, то вещество находится в газообразном состоянии; если много меньше, то в твердом. Жидкое состояние образуется при примерном равенстве этих энергий.
2.2. Основы молекулярно-кинетической теории идеальных газов
2.2.1 Модель идеального газа
Наиболее простой моделью является модель идеального газа. Это газ, состоящий из точечных материальных частиц с конечной массой, силами взаимодействия между которыми можно пренебречь, и которые сталкиваются между собой по законам соударения упругих шаров. Следовательно, молекулы идеального газа обладают только кинетической энергией, поскольку потенциальной энергией взаимодействия молекул можно пренебречь. Молекулы движутся непрерывно и беспорядочно, следовательно, в среднем скорости молекул газа в разных направлениях одинаковы. Тот факт, что частицы точечные, позволяет считать, что газ занимает весь предоставленный ему объём, то есть, любая молекула в любой момент времени может находиться в любом месте предоставленного объёма.
2.2.2 Основное уравнение молекулярно-кинетической теории идеального газа. Давление.
Основное уравнение молекулярно-кинетической теории идеального газа связывает макроскопический параметр газа с микроскопическими характеристиками, относящимися к его структурным элементам - молекулам. Учитывая беспорядочное непрерывное движение молекул и их соударения со стенками сосуда и друг с другом, макроскопическим параметром может быть давление газа, которое связано с изменением импульса молекул (микроскопический параметр).
Как известно,
величина давления определяется силой,
действующей перпендикулярно на единицу
площади поверхности:
![]() .
.
Рис. 2. 2
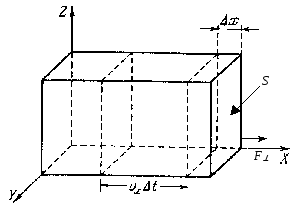
Давление газа на
стенки обусловлено огромным числом
столкновений молекул газа со стенками,
согласно второму закону Ньютона :
![]()
Импульс одной
молекулы: вдоль оси Х
равен
![]() ,
гдеm0
- масса одной молекулы. Пусть в единице
объема сосуда находится n
молекул, из них половина движется вдоль
оси Х,
а другая половина - в противоположном
направлении. За время t
в слой x
(x
– расстояние, на котором проявляется
действие молекул на стенку) слева направо
входит
,
гдеm0
- масса одной молекулы. Пусть в единице
объема сосуда находится n
молекул, из них половина движется вдоль
оси Х,
а другая половина - в противоположном
направлении. За время t
в слой x
(x
– расстояние, на котором проявляется
действие молекул на стенку) слева направо
входит
![]() молекул. Каждая из них обладает импульсом
молекул. Каждая из них обладает импульсом![]() ,
следовательно, общий импульс, вносимый
ими в слой, равен:
,
следовательно, общий импульс, вносимый
ими в слой, равен:![]() .
.
За это же время
слой покидает, двигаясь, справа налево,
такое же число молекул с таким же общим
импульсом, но противоположного знака.
Общее изменение импульса:
![]() .
.
Импульс силы,
действующей на стенку, площадью S,
равен изменению импульса частиц
![]() .
Тогда давление на стенку, будет
определяться формулой:
.
Тогда давление на стенку, будет
определяться формулой:
![]() (2.1)
(2.1)
Двигаясь беспорядочно
в пространстве, молекулы имеют составляющие
скоростей и вдоль других осей. Полная
скорость молекулы может быть выражена
через её составляющие по трём независимым
направлениям :
![]() .
.
Поскольку в движении
участвует множество молекул, то необходимо
использовать средние квадраты
скоростей:![]()
![]() .
.
Так как движение
беспорядочное, то все три компоненты
скоростей равноправны![]()
![]() .
Отсюда
.
Отсюда
![]() .
После подстановки в уравнение (2.1)
получим:
.
После подстановки в уравнение (2.1)
получим:![]() (2.2)
(2.2)
Уравнение (2.2)
связывает макроскопический параметр
давление и микроскопические – массу и
средний квадрат скорости молекулы,
поэтому его можно считать основным
уравнением МКТ идеальных газов.
Однако, часто это уравнение используют
в другом виде:
![]() . Здесь
. Здесь![]() - средняя кинетическая энергия
поступательного движения молекулы.
Таким образом, давление идеального газа
определяется средней кинетической
энергией поступательного движения
молекулы и является среднестатистической
величиной
- средняя кинетическая энергия
поступательного движения молекулы.
Таким образом, давление идеального газа
определяется средней кинетической
энергией поступательного движения
молекулы и является среднестатистической
величиной
![]() (2.3)
(2.3)
Давление газа пропорционально средней кинетической энергии поступательного движения молекулы.
Единица давления в СИ: 1 Па =1 Н/м2
Часто используют единицу измерения давления 1 бар=105 Па
В СГС: 1 дин/см2=0,1 Па
В технике используют :
1 ат =1 кг/см2 = 0,98 бар - техническая атмосфера
1 атм - физическая атмосфера - равна давлению столба ртути высотой 760 мм.
1 атм = 1,01 бар
В области низких давлений используют:
1 тор= 1/760 атм = 133,322 Па.
Измерение давления. Приборы для измерения давления - манометры. Манометры делят на первичные и вторичные. Первичные - те, которые непосредственно измеряют давление, вторичные - те, которые измеряют некоторую величину, связанную с давлением.
Манометры, используемые для измерения атмосферного давления, называются барометрами. Подробнее об устройстве и принципе действия этих приборов можно прочитать в литературе.
