
6.3. Энергия атомных орбиталей. Электронные уровни и подуровни
Узнав, какие орбитали возможны в атоме, постараемся теперь выяснить, какова их энергия, ведь роль энергии во всех процессах, протекающих во Вселенной, очень велика. Это относится и к микромиру, и к Космосу.
Энергия АО – энергия электрона, находящегося на этой орбитали (то есть в этом состоянии). |
Э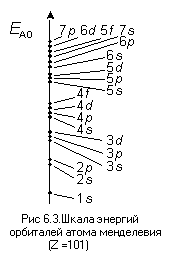 нергия
АО (ЕАО) может быть как рассчитана
из уравнения Шрёдингера, так и определена
экспериментально, что давно уже сделано
для атомов практически всех элементов.
Но при изучении химии эти точные
абсолютные значения используются редко.
Обычно бывает достаточно знать, энергия
какой орбитали больше, а какой меньше,
а также, сильно или слабо различаются
по энергии соседние орбитали. Такую
информацию дает, например, рис. 6.3, где
на оси энергии нанесены значения энергии
орбиталей атома менделевия (одного из
последних элементов, электронное
строение атома которого определено
экспериментально), как занятых электронами,
так и некоторых свободных. Значения
нанесены на ось без строгого соблюдения
масштаба, так как при увеличении главного
квантового числа разница между значениями
энергии АО уменьшается очень сильно,
поэтому сделанный в масштабе рисунок
был бы ненагляден. Есть и еще одна
причина, по которой эту шкалу обычно
изображают без соблюдения масштаба: по
мере возрастания заряда ядра энергия
одних и тех же орбиталей существенно
уменьшается, но при этом общая
закономерность распределения орбиталей
по энергии остается неизменной.
Изображенная на рис. 13 шкала точнее
отражает одну из уже известных нам
особенностей поведения электрона в
атоме (сравни с рис. 11).
Как видите,
последовательность состояний довольно
сложная. Обычно для большей наглядности
получившуюся шкалу несколько видоизменяют.
Обратите внимание, что энергия АО зависит
от n и от l, поэтому кроме оси ЕАО
вводят еще одну ось. Чаще всего это ось
l. На получившемся поле отмечают
положение энергии различных орбиталей,
но не точками, а маленькими квадратиками,
так называемыми "квантовыми
ячейками". При
этом, кроме увеличения наглядности,
появляется возможность показать число
разных орбиталей с одинаковой энергией.
нергия
АО (ЕАО) может быть как рассчитана
из уравнения Шрёдингера, так и определена
экспериментально, что давно уже сделано
для атомов практически всех элементов.
Но при изучении химии эти точные
абсолютные значения используются редко.
Обычно бывает достаточно знать, энергия
какой орбитали больше, а какой меньше,
а также, сильно или слабо различаются
по энергии соседние орбитали. Такую
информацию дает, например, рис. 6.3, где
на оси энергии нанесены значения энергии
орбиталей атома менделевия (одного из
последних элементов, электронное
строение атома которого определено
экспериментально), как занятых электронами,
так и некоторых свободных. Значения
нанесены на ось без строгого соблюдения
масштаба, так как при увеличении главного
квантового числа разница между значениями
энергии АО уменьшается очень сильно,
поэтому сделанный в масштабе рисунок
был бы ненагляден. Есть и еще одна
причина, по которой эту шкалу обычно
изображают без соблюдения масштаба: по
мере возрастания заряда ядра энергия
одних и тех же орбиталей существенно
уменьшается, но при этом общая
закономерность распределения орбиталей
по энергии остается неизменной.
Изображенная на рис. 13 шкала точнее
отражает одну из уже известных нам
особенностей поведения электрона в
атоме (сравни с рис. 11).
Как видите,
последовательность состояний довольно
сложная. Обычно для большей наглядности
получившуюся шкалу несколько видоизменяют.
Обратите внимание, что энергия АО зависит
от n и от l, поэтому кроме оси ЕАО
вводят еще одну ось. Чаще всего это ось
l. На получившемся поле отмечают
положение энергии различных орбиталей,
но не точками, а маленькими квадратиками,
так называемыми "квантовыми
ячейками". При
этом, кроме увеличения наглядности,
появляется возможность показать число
разных орбиталей с одинаковой энергией.
Квантовая ячейка – символическое изображение орбитали на энергетической диаграмме. |
Рядом с квантовыми ячейками обязательно обозначают символы орбиталей. В результате получается так называемая энергетическая диаграмма атома. Энергетическая диаграмма может отражать электронное строение реального атома, тогда на ней показывают положения электронов Но можно составить энергетическую диаграмму так, чтобы показать последовательность энергий еще не занятых электронами орбиталей – для произвольного многоэлектронного атома такая диаграмма приведена на рис. 6.4.
В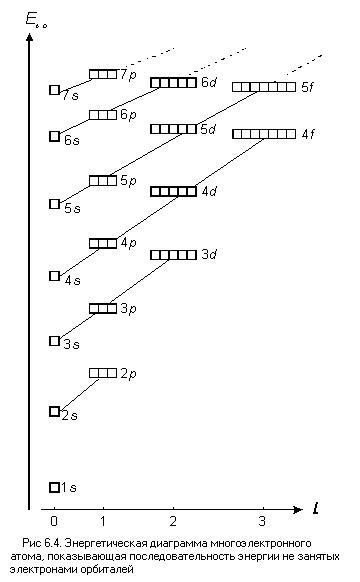 случае атома водорода, у которого –
только один электрон, картина сильно
упрощается. Как видно из энергетической
диаграммы (рис. 6.5), у атома водорода
энергия орбитали зависит только от
главного квантового числа n.
случае атома водорода, у которого –
только один электрон, картина сильно
упрощается. Как видно из энергетической
диаграммы (рис. 6.5), у атома водорода
энергия орбитали зависит только от
главного квантового числа n.
От магнитного квантового числа m энергия орбитали не зависит, на энергетической диаграмме орбитали с одинаковыми n и l, но с разным магнитным квантовым числом m, имеющие одинаковую энергию, группируются вместе, образуя электронный подуровень (ЭПУ) (см. рис. 6.4).
Число орбиталей на любом ЭПУ равно числу возможных значений m (см. табл. 13). Так, 2p-, 3p-, 4p- и других орбиталей p-подуровней – по три, а 3d-, 4d-, 5d- и других d-орбиталей – по пять. В общем случае число орбиталей на любом подуровне равно 2l + 1.
П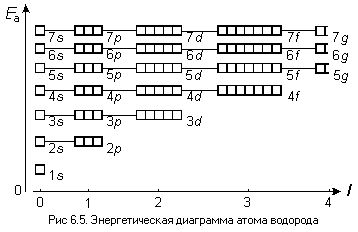 оскольку
все орбитали подуровня имеют одинаковый
символ, тем же символом обозначают и
сам подуровень. Так, 1s-подуровень
(1s-ЭПУ) образован одной 1s-АО, а
4f-ЭПУ – семью 4f-АО.
оскольку
все орбитали подуровня имеют одинаковый
символ, тем же символом обозначают и
сам подуровень. Так, 1s-подуровень
(1s-ЭПУ) образован одной 1s-АО, а
4f-ЭПУ – семью 4f-АО.
На энергетической диаграмме условно принято располагать орбитали по возрастанию магнитного квантового числа, например, для 3d-ЭПУ
|
|
|
|
|
3d |
–2 |
–1 |
0 |
+1 |
+2 |
|
левая квантовая ячейка символизирует орбиталь с m = –2, следующая – с m = –1 и далее до m = 2.
Подуровни с одинаковым значением главного квантового числа объединяют в электронные уровни (ЭУ).
Электронный уровень – совокупность орбиталей с одинаковыми значениями главного квантового числа. |
Так, 2s- и 2р-подуровни образуют второй электронный уровень; 3s-, 3p- и 3d-подуровни образуют третий электронный уровень.
Электронный подуровень – совокупность орбиталей одного уровня с одинаковыми значениями орбитального квантового числа. |
На энергетических диаграммах, показанных на рис. 6.4 и 6.5, подуровни одного уровня соединены прямыми линиями. В случае атома водорода эти линии горизонтальны, а в случае многоэлектронного атома – наклонны. Полезно знать, что число подуровней на одном уровне равно номеру этого уровня (то есть главному квантовому числу n), а число орбиталей на том же уровне равно n2.
Иногда электронные уровни называют "энергетическими уровнями". Это устаревшее, но все еще часто употребляемое название справедливо для атома водорода, но совершенно не отражает характер электронных оболочек многоэлектронных атомов (энергия атомных орбиталей одного электронного уровня у них разная). Именно при изучении электронной структуры атома водорода (простейшего атома!) это название и возникло. Точно так же электронные подуровни иногда называют "энергетическими подуровнями". Это название допустимо, так как отражает реальность: в пределах подуровня у любого атома энергии АО действительно равны. Но для того, чтобы не создавать лишней путаницы, его не стоит употреблять.
ЭНЕРГИЯ АО, КВАНТОВАЯ ЯЧЕЙКА, ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА АТОМА, ЭЛЕКТРОННЫЙ УРОВЕНЬ, ЭЛЕКТРОННЫЙ ПОДУРОВЕНЬ. 1.Энергия какого из электронов одного и того же атома, 1s или 2s, больше? Какой из них слабее связан с ядром? 2.На какой орбитали, 1s-АО атома водорода или 1s-АО атома гелия, электроны имеют большую энергию? Где они прочнее связаны с ядром? 3.Какие орбитали образуют четвертый электронный уровень? 4.Определите число АО на а) 3s-ЭПУ, б) 4f-ЭПУ. 5.Сколько электронных подуровней образуют а) третий электронный уровень, б) пятый электронный уровень, в) седьмой электронный уровень?
