
- •1. Історія вивчення
- •2. Функції ферментів
- •3. Класифікація ферментів
- •4. Угоди про найменування ферментів
- •5. Кінетичні дослідження
- •6. Структура і механізм дії ферментів
- •6.1. Специфічність
- •6.1.1. Модель "ключ-замок"
- •6.1.2. Модель індукованої відповідності
- •6.3. Кофактори ферментів
- •6.4. Регуляція роботи ферментів
- •6.4.1. Інгібування кінцевим продуктом
- •6.5. Вплив умов середовища на активність ферментів
- •7. Множинні форми ферментів
- •8. Медичне значення
- •9. Практичне використання
6.1. Специфічність
Ферменти зазвичай проявляють високу специфічність по відношенню до своїх субстратів (субстратна специфічність). Це досягається частковою комплементарностью форми, розподілу зарядів і гідрофобних областей на молекулі субстрату і в центрі зв'язування субстрату на ферменті. Ферменти зазвичай демонструють також високий рівень стереоспеціфічності (утворюють як продукт тільки один з можливих стереоізомерів або використовують як субстрат тільки один стереоізомер), региоселективность (утворюють або розривають хімічний зв'язок тільки в одному з можливих положень субстрату) і хемоселектівності (каталізують тільки одну хімічну реакцію з декількох можливих для даних умов). Незважаючи на загальний високий рівень специфічності, ступінь субстратної і реакційної специфічності ферментів може бути різною. Наприклад, ендопептідаза трипсин розриває пептидную зв'язок тільки після аргініну або лізину, якщо за ними не слід пролін, а пепсин набагато менш специфічний і може розривати пептидних зв'язок, наступну за багатьма амінокислотами.
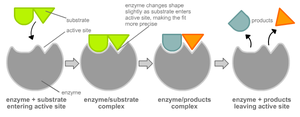
6.1.1. Модель "ключ-замок"
Гіпотеза Кошланда про індукований відповідно
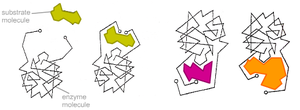
Більш реалістична ситуація у випадку індукованого відповідності. Неправильні субстрати - занадто великі або занадто маленькі - не підходять до активного центру
У 1890 р. Еміль Фішер припустив, що специфічність ферментів визначається точною відповідністю форми ферменту і субстрату [8]. Таке припущення називається моделлю "ключ-замок". Фермент з'єднується з субстратом з утворенням короткоживучого фермент-субстратного комплексу. Проте, хоча ця модель пояснює високу специфічність ферментів, вона не пояснює явища стабілізації перехідного стану, який спостерігається на практиці.
6.1.2. Модель індукованої відповідності
У 1958 р. Деніел Кошланд запропонував модифікацію моделі "ключ-замок" [9]. Ферменти, в основному, - не жорсткі, а гнучкі молекули. Активний центр ферменту може змінити конформацію після зв'язування субстрату. Бічні групи амінокислот активного центру приймають таке положення, яке дозволяє ферменту виконати свою каталітичну функцію. У деяких випадках молекула субстрата також міняє конформацію після зв'язування в активному центрі. На відміну від моделі "ключ-замок", модель індукованої відповідності пояснює не тільки специфічність ферментів, але і стабілізацію перехідного стану. Ця модель отримала назву "рука-рукавичка".6.2. Модифікації
Багато ферментів після синтезу білкового ланцюга зазнають модифікації, без яких фермент не проявляє свою активність повною мірою. Такі модифікації називаються посттрансляційних модифікаціями (процесингом). Один з найпоширеніших типів модифікації - приєднання хімічних груп до бічних залишків поліпептидного ланцюга. Наприклад, приєднання залишку фосфорної кислоти називається фосфорилюванням, воно каталізується ферментом кінази. Багато ферментів еукаріот глікозильований, тобто модифіковані олігомерами вуглеводної природи.
Ще один поширений тип посттранляціонних модифікацій - розщеплення поліпептидного ланцюга. Наприклад, хімотрипсин ( протеаза, що бере участь в травленні), виходить при вищепленіі поліпептидного ділянки із хімотрипсиногену. Химотрипсиноген є неактивним попередником хімотрипсину і синтезується в підшлунковій залозі. Неактивна форма транспортується в шлунок, де перетворюється на хімотрипсин. Такий механізм необхідний для того, щоб уникнути розщеплення підшлункової залози та інших тканин до надходження ферменту в шлунок. Неактивний попередник ферменту називають також "зімогенние".
