
6. Смещение химического равновесия. Принцип Ле Шателье
Так как почти все реакции в той или иной степени обратимы, в промышленности и лабораторной практике возникают две проблемы: как получить продукт " полезной" реакции с максимальным выходом и как уменьшить выход продуктов " вредной" реакции. И в том, и в другом случае возникает необходимость сместить равновесие либо в сторону продуктов реакции, либо в сторону исходных веществ. Чтобы научиться это делать, надо знать, от чего зависит положение равновесия любой обратимой реакции.
Положение равновесия зависит: 1) от значения константы равновесия (то есть от природы реагирующих веществ и температуры), 2) от концентрации веществ, участвующих в реакции и 3) от давления (для газовых систем оно пропорционально концентрациям веществ). Для качественной оценки влияния на химическое равновесие всех этих очень разных факторов используют универсальный по своей сути принцип Ле Шателье (французский физикохимик и металловед Анри Луи Ле Шателье сформулировал его в 1884 году), который применим к любым равновесным системам, не только химическим.
Если на систему, находящуюся в равновесии, воздействовать извне, то равновесие в системе сместится в направлении, в котором происходит частичная компенсация этого воздействия.
В качестве примера влияния на положение равновесия концентраций веществ-участников реакции рассмотрим уже известную вам обратимую реакцию получения йодоводорода
H2(г) + I2(г) 2HI(г).
По закону действующих масс в состоянии равновесия
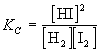 .
.
Пусть в реакторе объемом 1 литр при некоторой постоянной температуре установилось равновесие, при котором концентрации всех участников реакции одинаковы и равны 1 моль/л ([H2] = 1 моль/л; [I2] = 1 моль/л; [HI] = 1 моль/л). Следовательно, при этой температуре КС = 1. Так как объем реактора 1 литр, n(H2) = 1 моль, n(I2) = 1 моль и n(HI) = 1 моль. В момент времени t 1 введем в реактор еще 1 моль HI, его концентрация станет равной 2 моль/л. Но, чтобы КС оставалась постоянной, должны увеличиться концентрации водорода и йода, а это возможно только за счет разложения части йодоводорода по уравнению
2HI(г) = H2(г) + I2(г).
Пусть к моменту достижения нового состояния равновесия t 2 разложилось x моль HI и, следовательно, образовалось дополнительно по 0,5x моль H2 и I2. Новые равновесные концентрации участников реакции: [H2] = (1 + 0,5x) моль/л; [I2] = (1 + 0,5x) моль/л; [HI] = (2 - x) моль/л. Подставив числовые значения величин в выражение закона действующих масс, получим уравнение
![]() .
.
Откуда x = 0,667. Следовательно, [H2] = 1,333 моль/л; [I2] = 1,333 моль/л; [HI] = 1,333 моль/л.
Все эти изменения концентраций наглядно показаны на рисунке 9.3 а.
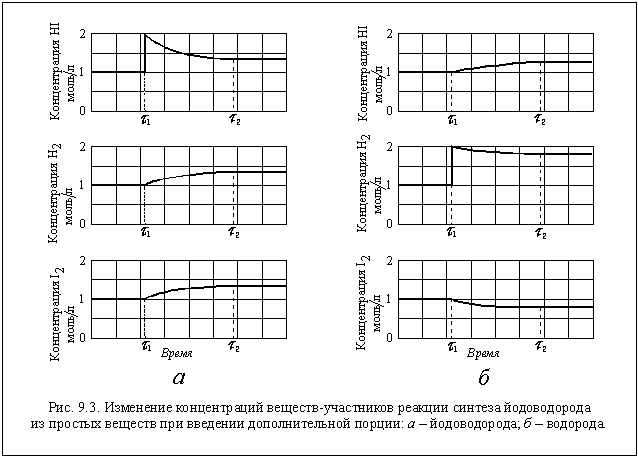
В результате введения в реактор дополнительной порции HI равновесие в системе нарушилось и сместилось в сторону образования исходных веществ (H2 и I2). В данном случае - это обратная реакция. Следовательно, равновесие сместилось в сторону обратной реакции (" влево" ). Если в тот же реактор при тех же условиях ввести 1 моль водорода, то равновесие сместится в направлении, в котором водород вступит в реакцию, и его концентрация за счет этого понизится, а концентрация HI повысится. Это происходит в прямой реакции, и , следовательно, теперь равновесие смещается в сторону прямой реакции (" вправо" ). Легко посчитать новые равновесные концентрации в этом случае: [H2] = 1,865 моль/л; [I2] = 0,865 моль/л; [HI] = 1,270 моль/л (см. рис. 9.3 б).
Таким образом, введение в систему одного из веществ-участников реакции приводит к смещению равновесия в направлении, в котором это вещество расходуется. В качестве примера влияния на положение равновесия температуры рассмотрим обратимую реакцию синтеза аммиака N2(г) + 3H2(г) 2NH3(г). Прямая реакция здесь экзотермическая: N2(г) + 3H2(г) = 2NH3(г) + Q, и, следовательно, обратная реакция - эндотермическая: 2NH3(г) = N2(г) + 3H2(г) - Q.
В прямой реакции выделяется теплота. Если нам нужно сместить равновесие вправо, то есть в сторону прямой реакции, то выделение теплоты должно стать " ответом" системы на внешнее воздействие, а именно - на отвод теплоты. А отводя теплоту, мы понижаем температуру в реакторе. Наоборот, если мы нагреем реакционную смесь, то есть подведем теплоту, " ответом" системы будет поглощение теплоты, которое может произойти только при смещении равновесия " влево" . Таким образом, при нагревании равновесие смещается в сторону эндотермической реакции, а при охлаждении - наоборот. Конечно, и в этой системе равновесие можно сместить, меняя концентрации веществ-участников реакции. Но посмотрим, как сместится равновесие в этой системе, если увеличить давление. По принципу Ле Шателье равновесие должно сместиться в сторону, компенсирующую внешнее воздействие, то есть в направлении той реакции, в которой при постоянном объеме общее давление уменьшается. Это возможно только при уменьшении общего числа молекул в системе. Общее число молекул уменьшается в ходе прямой реакции, следовательно, равновесие сместится в сторону образования аммиака. И наоборот, при понижении давления равновесие сместится в сторону образования азота и водорода.
