
- •Інструкція з безпеки для кабінету (лабораторії) хімії
- •Загальні положення
- •3 Вимоги безпеки під час виконання роботи
- •4. Вимоги безпеки після закінчення роботи
- •5. Вимоги безпеки в екстремальних ситуаціях
- •Лабораторна робота №1
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 2
- •Хід роботи.
- •Контрольні запитання.
- •Лабораторна робота №3
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота № 4
- •Хід роботи
- •Контрольні запитання
- •Лабораторна робота № 5
- •Хід роботи
- •2.1. Окислення мурашиного альдегіду купрум гідроксидом
- •2.2. Окислення мурашиного альдегіду аргентум нітратом
- •Контрольні запитання.
- •Лабораторна робота № 6
- •Хід роботи
- •Лабораторна робота №7
- •Хід роботи
- •1. Вивчення властивостей глюкози.
- •1.1.Реакції глюкози, як багатоатомного спирту
- •1.2. Реакції глюкози, як альдегіду
- •3.1. Доведення мономерного складу цукрози
- •Контрольні запитання.
- •Лабораторна робота №8
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №9
- •Хід роботи
- •Контрольні запитання.
- •Лабораторна робота №10
- •Хід роботи
- •Література
Хід роботи
1. Вивчення властивостей глюкози.
1.1.Реакції глюкози, як багатоатомного спирту
В пробірку налийте 1-1,5мл глюкози, додайте купрум(ІІ) гідроксиду, добутого таким чином: до розбавленого розчину купрум сульфату долити надлишок натрій гідроксиду. Злити надлишок рідини з купрум гідроксиду до осаду ,що залишився додати 2-3 мл води і збовтати. Запишіть рівняння реакції, спостереження та висновки.
1.2. Реакції глюкози, як альдегіду
В пробірку налийте невелику кількість розчину глюкози, додайте реактиву Фелінга, затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення. Запишіть рівняння реакції, спостереження та висновки..
Дослід 2.Вивчення властивостей фруктози, як кетоноспирту
В пробірку налийте невелику кількість розчину фруктози, додайте реактиву Селіванова , затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення .Запишіть рівняння реакції, спостереження та висновки..
Дослід 3 Інверсія цукрози
В пробірку налийте невелику кількість розчину цукрози, додайте розчину соляної кислоти( обережно!),затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення .Запишіть рівняння реакції, спостереження та висновки.
3.1. Доведення мономерного складу цукрози
Отриманий в попередньому досліді гідролізат розділіть на дві пробірки. До першої додайте реактиву Селіванова, затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення. Запишіть рівняння реакції, спостереження та висновок про присутність в гідролізаті фруктози. До другої частини гідролізату додайте надлишок соди для нейтралізації кислоти до припинення виділення газу, додайте реактиву Фелінга, затисніть пробірку в тримачі і обережно нагрівайте до зміни забарвлення. Запишіть рівняння реакції, спостереження та висновок про присутність в гідролізаті глюкози.
Контрольні запитання.
Що таке вуглеводи ? Як вони класифікуються?
Які функції вуглеводів в живих клітинах?
Яке значення вуглеводів в житті людини ?
Які хімічні властивості вуглеводів ви знаєте?
Якими реакціями можна виявити глюкозу ?
Який реактив є якісним на фруктозу ?
Чому цукровий сироп солодший за цукор?
Виконати перетворення: карбон →метан→ метанол→ метаналь→ глюкоза→ клюконова кислота
Лабораторна робота №8
Тема. Вивчення властивостей полісахаридів( крохмалю ).
Мета : провести кислотний та ферментативний гідроліз крохмалю, виявити продукти гідролізу.
Прилади і реактиви : сира і варена картопля, крохмаль, крохмальний клейстер (C6H10O5)n, спиртовий розчин йоду (I2),соляна кислота (HCl), штатив з пробірками, тримачі, пальник.
Найважливішими представниками полісахаридів є крохмаль і целюлоза. Молекули цих природних полімерів побудовані з ланок —С6Н10O5—, які є залишками молекул глюкози, що втратили молекулу води. Тому склад крохмалю і целюлози виражається загальною формулою (С6Н10O5)n. Відмінність у властивостях природних полімерів глюкози зумовлена будовою цих речовин: макромолекули крохмалю побудовані із залишків α-глюкози, а макромолекули целюлози — із залишків молекул β-глюкози.
Крохмаль (С6Н10O5)n поширений у природі. Для різних рослин — він запасний поживний матеріал і міститься в них у вигляді крохмальних зерен. Масова частка його у бульбах картоплі становить приблизно 20 %, в зернах пшениці — біля 70 %, рису — біля 80 %.
Крохмаль — білий порошок, що не розчиняється у холодній воді; у гарячій воді він набрякає, утворюючи клейстер. З розчином йоду дає синє забарвлення ( якісна реакція).
Молекули крохмалю неоднорідні за величиною — значення п у них коливається від сотень до 1000—5000 чи більше.
Найважливіша хімічна властивість крохмалю — його гідроліз, кінцевим продуктом якого α глюкоза. Сумарне рівняння можна виразити так:
(C6H10O5)n + nH2O → nC6H12O6
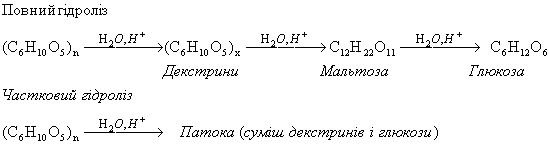
Звідси можна зробити висновок, що макромолекула крохмалю побудована із залишків молекул глюкози.
Процес утворення макромолекул
можна схематично зобразити так:
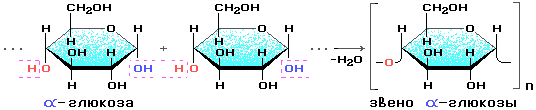
Оскільки циклічні ланки молекул не містять альдегідних груп, то відновних властивостей крохмаль практично не проявляє.
Крохмаль утворюється в результаті фотосинтезу в зелених рослинах з участю хлорофілу — зеленого пігменту рослин. Хлорофіл вбирає сонячне світло, і за рахунок цієї енергії здійснюється ряд реакцій між оксидом вуглецю (IV) і водою. Фотосинтез можна подати таким сумарним рівнянням:
6CO2+6Н2О→С6Н12О6 + 6О2
Далі глюкоза через ряд проміжних стадій перетворюється у крохмаль:
Продукти фотосинтезу внаслідок вбирання енергії сонячних променів володіють великим запасом енергії. За рахунок цієї енергії, яка виділяється при окисненні органічних речовин в організмі, і можлива його життєдіяльність.
У промисловості крохмаль виробляють переважно з бульб картоплі, а також із кукурудзи.
Застосування крохмалю різноманітне. Він є основним вуглеводом продуктів харчування людини — хліба, крупів, картоплі. Значні кількості його переробляють на декстрини, патоку і глюкозу, які використовують у кондитерському виробництві.
З крохмалю, який є в картоплі і зернах злаків, добувають етиловий спирт. Для цього крохмаль спочатку перетворюють на глюкозу під дією ферментів, а потім глюкозу піддають спиртовому бродінню за наявності дріжджів.
Крохмаль використовують як засіб для клеєння, обробки тканин, крохмалення білизни. У медицині на основі крохмалю виготовляють мазі, присипки тощо.
Целюлоза, або клітковина,— ще більш поширений вуглевод, ніж крохмаль. З неї складаються в основному стінки рослинних клітин. Масова частка целюлози у деревині становить біля 60 %, у ваті і фільтрувальному папері — 90 %.
Целюлоза — тверда волокниста речовина, нерозчинна у воді і органічних розчинниках. Склад целюлози, як і крохмалю, зображують формулою (СбНіоОз)n. Величина п у деяких видах целюлози досягає 40 000, а молекулярна маса становить кілька мільйонів. Молекули її мають лінійну (нерозгалужену) будову, тому целюлоза легко утворює волокна. Молекули ж крохмалю мають як лінійну, так і розгалужену будову. У цьому основна відмінність крохмалю від целюлози.
Молекули целюлози побудовані із залишків молекул р-глю-кози. Процес їх сполучення можна схематично зобразити так:
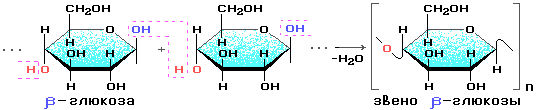
Невеликі відмінності у будові молекул зумовлюють значні відмінності у властивостях природних полімерів: крохмаль — продукт харчування, целюлоза для цієї мети непридатна.
Подібно до крохмалю, целюлоза при нагріванні з розведеними кислотами піддається гідролізу, утворюючи глюкозу.
Гідроліз целюлози, відомий також під назвою оцукрення,— дуже важлива властивість целюлози, він дає змогу добувати з деревної тирси і стружок глюкозу, а зброджуванням останньої — етиловий спирт. Цей спирт, добутий із деревини, називається гідролізним.
На гідролізних заводах з 1 т деревини виробляють до 200 л етилового спирту, що замінює 1,5 т картоплі або 0,7 т зерна.
Сира глюкоза, добута з деревини, може бути кормом для худоби.
Оскільки целюлоза — полімер глюкози, її молекули містять спиртові гідроксильні групи. У кожному залишку глюкози таких груп три, і формулу целюлози можна подати так:
C2H7O2(OH)3
Тому з неї можна добути етери та естери. Целюлоза легко взаємодіє з азотною кислотою і утворює естери — моно-, ди- та тринітратцелюлози:

Тринітротцелюлоза, або як її ще називають піроксилін,— вибухова речовина, яка використовується при виготовленні порохів.
З оцтовою кислотою целюлоза утворює естери — моно-, ди-та триацетатцелюлози.
З триацетатцелюлози виготовляють негорючу фото- і кіноплівку, різні прозорі пластмаси.
Це лише окремі приклади застосування целюлози. У вигляді бавовнику, льону, прядива вона йде на виготовлення тканин — бавовняних і лляних. Великі кількості її витрачаються на виробництво паперу. Піддаючи целюлозу хімічній переробці, виробляють кілька видів штучного шовку.
